
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中含有K+ | |
| B. | 向无色溶液中加入BaCl2溶液有白色沉淀出现,则溶液中含有SO42ˉ | |
| C. | 用一束光照射氯化铁溶液和氢氧化铁胶体,都出现丁达尔现象 | |
| D. | 向某溶液中加入NaOH溶液后再加热,若产生的气体能使湿润红色石蕊试纸变蓝,则该溶液中肯定有NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3相互转化的反应是可逆反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

 +(2n-1)H2O.
+(2n-1)H2O. .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
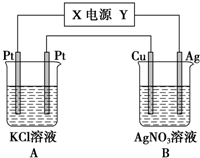 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气工厂爆炸时可用湿布捂住鼻孔、眼睛等并躲在下风的低洼处 | |
| B. | 二氧化硫可用来加工食品,使食品增白 | |
| C. | 锂可用于制造质量轻、电容量大的可充电电池 | |
| D. | 高纯度二氧化硅是制造太阳能电板的材料之一 |
查看答案和解析>>
科目: 来源: 题型:解答题
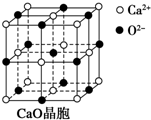 可以由下列反应合成三聚氰胺:
可以由下列反应合成三聚氰胺: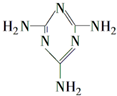 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸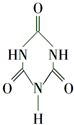 后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.
后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.查看答案和解析>>
科目: 来源: 题型:解答题
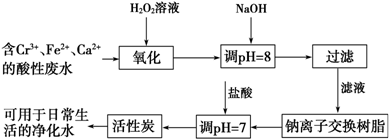
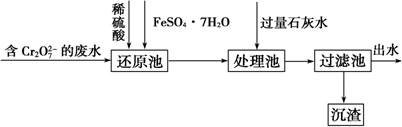
查看答案和解析>>
科目: 来源: 题型:解答题
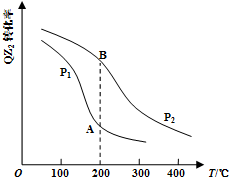 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答: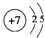 .
.| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com