
科目: 来源: 题型:解答题
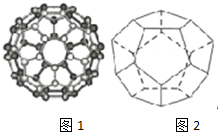 碳是最早被发现和利用的元素之一,长期以来人们以为单质碳的同素异形体只有精钢石、石墨、和无定型碳三种,1985年C60的发现将人类领入认识碳的全新领域--富勒烯,美国科学家Curl和Stnalley教授及英国科学家Kicto教授为此获得了1996年闹贝尔化学奖
碳是最早被发现和利用的元素之一,长期以来人们以为单质碳的同素异形体只有精钢石、石墨、和无定型碳三种,1985年C60的发现将人类领入认识碳的全新领域--富勒烯,美国科学家Curl和Stnalley教授及英国科学家Kicto教授为此获得了1996年闹贝尔化学奖查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 反应开始至a点时,v(X)=1mol•L-1•min-1 | |
| B. | 4min时,正反应速率:Ⅱ>Ⅰ | |
| C. | 曲线Ⅲ对应点的条件改变是减小压强 | |
| D. | T℃时,该反应的化学平衡常数为1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向某溶液中加入盐酸化的BaCl 2 溶液,产生白色沉淀,说明溶液中含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中通入CO2气体产生的白色沉淀,说明溶液中含有Ca2+ | |
| C. | 含有大量Cl-、CO${\;}_{4}^{2-}$、OH-的五色溶液中,可以依次加入酚酞、BaCl2、硝酸酸化的AgNO3溶液加以验证 | |
| D. | 向某浅绿色溶液中加入KSCN溶液后溶液不变红,再加入H2O2溶液后溶液变红,说明其中含有Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等浓度的两溶液中水的电离程度:HCl>BOH | |
| B. | BOH的电离方程式是BOH?B++OH- | |
| C. | 混合溶液中:c(B)+>c(OH-)>c(Cl-)>c(H)+ | |
| D. | 要使混合溶液的pH=7,则需VHCl>VBOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=1的溶液中:NH${\;}_{4}^{+}$、Fe3+、SO${\;}_{4}^{2-}$、I- | |
| B. | 通入SO2气体产生白色沉淀的溶液中:Fe2+、N0${\;}_{3}^{-}$、Ba2+、H+ | |
| C. | c(HCO${\;}_{3}^{-}$)=0.1 mol/L的溶液中:Al3+、Na+、AlO${\;}_{2}^{-}$、SO${\;}_{4}^{2-}$ | |
| D. | 由水电离出的c(H)+=1×10-13mol/L的溶液中:Na+、S042-、Cl-、K+ |
查看答案和解析>>
科目: 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层
X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层| A. | 气态氢化物的稳定性:Y>Z | |
| B. | 最高价氧化物物对应水化物酸性:Z>W | |
| C. | X的气态氢化物与Y、Z、W的气态氢化物都可以反应 | |
| D. | 气态氢化物的沸点,Y最高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水晶、陶瓷、玻璃的主要成分都是硅酸盐 | |
| B. | 合金的熔点通常比組分金属低.硬度比组合分金属高 | |
| C. | 自行车钢架生锈主要是电化学腐蚀所致 | |
| D. | 聚氯乙烯不能做食品包装袋 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 取一定浓度的NaOH溶液,通入一定量的CO2气体后,再逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示,
取一定浓度的NaOH溶液,通入一定量的CO2气体后,再逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示,查看答案和解析>>
科目: 来源: 题型:填空题
 A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式:
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com