
科目: 来源: 题型:选择题
| A. | X2+2Y2?2XY2 | B. | 2X2+Y2?2X2Y | C. | X2+3Y2?2XY3 | D. | 3X2+Y2?2X3Y |
查看答案和解析>>
科目: 来源: 题型:解答题
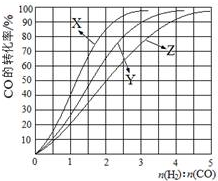
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
 ,
,查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N2O4,发生反应:N2O4(g)?2NO2(g)△H=+57.0kJ•mol-1,NO2和N2O4的浓度如图甲所示.NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N2O4,发生反应:N2O4(g)?2NO2(g)△H=+57.0kJ•mol-1,NO2和N2O4的浓度如图甲所示.NO2和N2O4的消耗速率与其浓度的关系如乙图所示,查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
查看答案和解析>>
科目: 来源: 题型:填空题
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3与O2起始时物质的量之比等于4:5,则平衡后两物质的转化率一定相等 | |
| B. | 平衡时4v正(O2)=5v逆(NO) | |
| C. | 平衡后降压,混合气体平均摩尔质量减小 | |
| D. | 达到平衡时放出热量为905.9 kJ,则起始时投入4mol NH3和5mol O2 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com