
科目: 来源: 题型:解答题
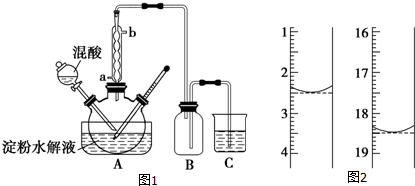
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食用植物油是人体的营养物质 | |
| B. | 分馏、干馏是物理变化,裂化、裂解是化学变化 | |
| C. | 淀粉、蛋白质、葡萄糖都是高分子化合物 | |
| D. | 甲烷、汽油、酒精都是碳氢化合物,都可作燃料 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
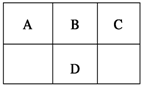 现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )
现有A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D的主要化合价为-2、+6,E2+的质子数比D的质子数多4,下列说法正确的是( )| A. | C可分别与A、E元素形成离子化合物 | |
| B. | D可形成三种价态的酸 | |
| C. | 原子半径:E>D>B>A>C | |
| D. | 最常见气态氢化物的稳定性:C>B>D>A |
查看答案和解析>>
科目: 来源: 题型:选择题
| Y | V | |||
| X | W |
| A. | 原子半径:X>Y>V>W | |
| B. | X、W的质子数之和与最外层电子数之和的比值为 2:1 | |
| C. | 甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键 | |
| D. | 在足量的沸水中滴入含有16.25 g ZW3的溶液可得到0.1 mol Z(OH)3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 硅胶吸附能力强,常用作催化剂载体和食品干燥剂 | |
| C. | 工业上利用Cl2与澄清石灰水反应制取漂白粉 | |
| D. | 天然纤维和合成纤维的主要成分是纤维素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同温同压下,体积相同的氢气和氩气所含的分子数相等 | |
| B. | 标准状况下22.4 L乙醇中分子数为NA | |
| C. | 在1 L 2 mol/L的盐酸中,存在2NA个氯化氢分子 | |
| D. | 1.8g的NH4+中含有的电子数为1.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 胶体是纯净物 | |
| B. | 胶体的分散质有可能带电,但胶体不带电 | |
| C. | 胶体、溶液与浊液的本质区别在于是否有丁达尔效应 | |
| D. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中,可得氢氧化铁胶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 含有金属元素的离子一定都是阳离子 | |
| C. | 金属氧化物不一定能与酸反应生成盐和水 | |
| D. | 由同种元素组成的物质肯定是纯净物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生石灰、白磷、熟石灰 | B. | 干冰、铁、氯化氢 | ||
| C. | 天然气、氮气、胆矾 | D. | 烧碱、液态氧、碘酒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com