
科目: 来源: 题型:解答题
 已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$ 2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$ 2SO3(g)反应过程的能量变化如图所示.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
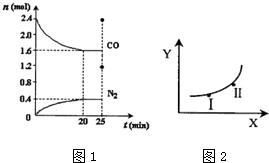
| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 元素 | 相关信息 |
| X | X元素可形成自然界中硬度最大的物质 |
| Y | 其单质为双原子分子,其最简单氢化物的水溶液能使酚酞变红 |
| Z | Z是短周期内最容易失去电子的元素 |
| M | M的一种同位素的质量数为34,中子数为18 |
| N | N是具有紫红色光泽的金属,有很好的延展性、导热性和导电性 |
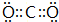 .
.查看答案和解析>>
科目: 来源: 题型:填空题
 A、B、C、D、E进行焰色反应均显黄色,这些物质能实现如图所示的转化关系.其中A为淡黄色固体,C为强碱.
A、B、C、D、E进行焰色反应均显黄色,这些物质能实现如图所示的转化关系.其中A为淡黄色固体,C为强碱.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠可用作漂白剂和呼吸面具中的供氧剂 | |
| B. | 钠和钾的合金常温下是固体,可用于快中子反应堆作热交换剂 | |
| C. | 碳酸氢钠是焙制糕点所用的发酵粉之一,也可以用于治疗胃酸过多 | |
| D. | 热的碳酸钠溶液可以去除物品表面的油污 |
查看答案和解析>>
科目: 来源: 题型:填空题
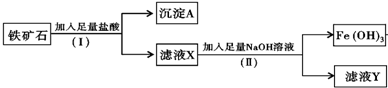
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下2.24LO2 | B. | 含NA个氢原子的H2 | ||
| C. | 44gCO2 | D. | 含3.01×1023个分子的CH4 |
查看答案和解析>>
科目: 来源: 题型:解答题
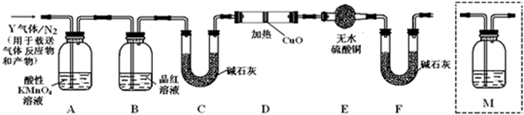
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com