
科目: 来源: 题型:解答题
 乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:回答下列问题:
乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 1-丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目: 来源: 题型:填空题
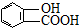 ⑤聚乙烯 ⑥
⑤聚乙烯 ⑥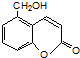

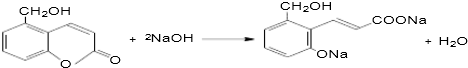
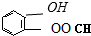 、
、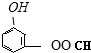 、
、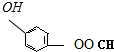
 ,聚乙二酸乙二酯H0
,聚乙二酸乙二酯H0 OCOCOOCH2CH2
OCOCOOCH2CH2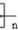 OH.
OH.查看答案和解析>>
科目: 来源: 题型:填空题

| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
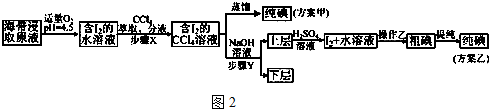
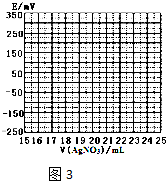
查看答案和解析>>
科目: 来源: 题型:填空题
 已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量. .
.查看答案和解析>>
科目: 来源: 题型:填空题
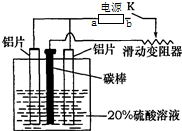 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜.某化学研究小组在实验室中按下列步骤模拟该生产过程,装置如图.填写下列空白:
铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜.某化学研究小组在实验室中按下列步骤模拟该生产过程,装置如图.填写下列空白:查看答案和解析>>
科目: 来源: 题型:选择题
| A配置0.10mol/LNaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  |  |
| A. | 配制0.10mol/L NaOH溶液 | |
| B. | 除去CO中的CO2 | |
| C. | 苯萃取碘水中的I2分出水层后的操作 | |
| D. | 记录滴定终点读数为12.20mL |
查看答案和解析>>
科目: 来源: 题型:解答题

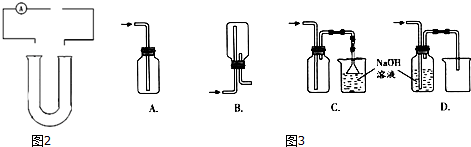
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com