
科目: 来源: 题型:选择题
| A. | Na+、K+、S2-、NO3- | B. | Na+、NO3-、SO42-、NH3.H2O | ||
| C. | K+、Ba2+、H2O2、Cl- | D. | Na+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| Kw/mol2•L-2 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸镁溶液跟氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| B. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
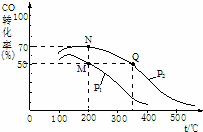 减少污染、保护环境是全世界最热门的课题.请回答下列问题:
减少污染、保护环境是全世界最热门的课题.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:查看答案和解析>>
科目: 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率v(PCl3)=0.003 2 mol•L-1•s-1 | |
| B. | 保持其他条件不变;升高温度;平衡时c(PCl3)=0.11 mol•L-1;则反应的△H<0 | |
| C. | 相同温度下;起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2;反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下;起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2;达到平衡时;PCl3的转化率小于80% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═-485 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(g);△H═-485 kJ/mol | ||
| C. | 2H2(g)+O2 (g)═2H2O(g);△H═+485 kJ/mol | D. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═+485 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com