
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合 | |
| B. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| C. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 | |
| D. | 已知4H++4I-+O2=2I2+2H2O,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol•L-1KI溶液、0.1 mol•L-1稀硫酸外,还需要用到淀粉溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
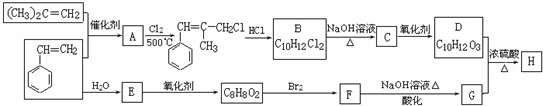
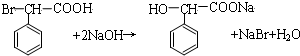 .
.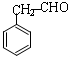 .
.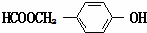 (写结构简式).
(写结构简式).查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金刚石是自然界最坚硬的单质 | |
| B. | 1 mol CO2中含有的共用电子对数目为2NA | |
| C. | 46g Na完全反应需要标准状况下CO2的体积为33.6L | |
| D. | 当有0.4mo1 Na参与反应时,被还原的CO2的分子数目为0.1 NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知A为常见的金属单质,各物质有如图所示的关系:
已知A为常见的金属单质,各物质有如图所示的关系:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 平均风速(m/s) 天气情况 | 空气中SO2的平均含量(mg/L) |
| 雨前 | 0.03 |
| 雨后 | 0.01 |
| 晴 | 0.015 |
| 晴 | 0.03 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com