
科目: 来源: 题型:选择题
| A. | 还原剂是HCl,氧化剂是KMnO4 | |
| B. | 每生成1mol Cl2转移电子的物质的量为2mol | |
| C. | 氧化剂与还原剂的物质的量之比为1:8 | |
| D. | 氧化产物与还原产物的物质的量之比为5:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解质:CO2、Ca(OH)2、H2O、HNO3 | B. | 碱:NaOH、Ba(OH)2、Na2CO3、NH3•H2O | ||
| C. | 碱性氧化物:CaO、Na2O、FeO、Mn2O7 | D. | 盐:NH4NO3、KAl(SO4)2、NH4Cl、NaHCO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| C. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| D. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 溶质 | Na2SO4 | BaCl2 | FeCl3 |
| C(mol/L) |
查看答案和解析>>
科目: 来源: 题型:解答题
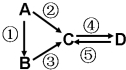 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目: 来源: 题型:选择题
 已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1| A. | 反应②中的能量变化如右图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑥ | B. | ①③④⑥⑦⑧ | C. | ②⑤⑧ | D. | ①④⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | S2- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L酒精含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01 NA | |
| C. | 11.2 L H2所含的电子数为NA | |
| D. | 通常状况下,NA个CO2分子含有电子数为22 NA |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 21:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com