
科目: 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:填空题
二水合重重铬酸钠(Na2Cr2O7.2H2O),[已知M(Na2Cr2O7.2H2O)=298g/mol]俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO.Cr2O3,还含有A1203、MgO、Si02等杂质)为主要原料生产,其主要工艺流程如图:
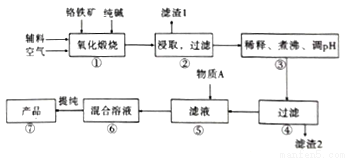
已知信息:
Ⅰ.“①”中涉及的主要反应是:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
Ⅱ.部分阳离子以氢氧化物形式完全沉淀时溶液的PH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液PH | 4.7 | 3.7 | 11.2 | 5.6 |
(1).杂质A12O3、SiO2与纯碱反应转变为可溶性盐,写出A12O3纯碱反应的化学方程式为:______________,滤渣1的主要成分为__________________。
(2).“③”中通过调节PH除去杂质,调节PH至___________。
(3).“⑤”中向滤液中加入物质A,得到Na2Cr2O3和Na2SO4的混合溶液,物质A为__________,简述原因:______________________________。(用离子方程式及文字加以说明)
(4).如图是Na2Cr2O3.2H2O和Na2SO4的溶解度曲线。提纯的实验操作:将Na2Cr2O3和Na2SO4的混合溶液______________________,得到Na2SO4固体和较纯净的Na2Cr2O3溶液。
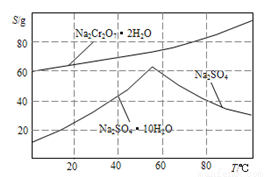
(5).实验室测定所得产品中红矾钠的纯度,称取产品3.2g,配成250mol溶液,取出25.00mL于锥形瓶中,加入10mL2mol/LH2SO4和足量碘化钾,放于暗处5min,写出离子方程式:________________。然后加水100mL,加入3mL淀粉指示剂,用0.1000mol/LNa2S2O3标准溶液滴定I2+2S2O32-=2I-+S4O62-若达到滴定终点时,共用去Na2S2O3标准溶液60mL,所得产品的纯度是_________(结果保留小数点后1位)。
查看答案和解析>>
科目: 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:实验题
固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
甲:Fe2O3、NO2乙:Fe2O3、NO2、O2丙:Fe3O4、NO2、O2丁:FeO、NO2、N2
(1).实验前,小组成员经讨论认定猜想丁不成立,理由是__________________.
针对上述猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):
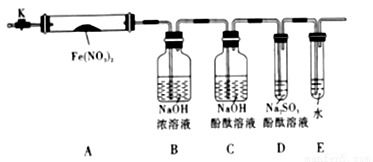
(2).实验过程
①仪器连接后,放人固体试剂之前,应______________
②称取Fe(NO3)2固体3.6g置于A中,加热前先打开K,___________,后再关闭K,用酒精灯加热
③观察到A中有红棕色气体出现,C、D中未见明显变化.
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.6g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象.
(3).实验结果分析讨论:
①根据实验现象和剩余固体的质量经分析,可初步确认分解产物中有____________。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中溶液颜色会退去;另一个同学认定分解产物中有O2存在,未检侧到的原因是_________________。
③为了验证是否有O2,某同学另称Fe(NO3)2固体3.6g,充分加热,收集气体,假设产生的气体全部收集,将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于2/3,通入一定量的O2后,气体全部被吸收,请写出Fe(NO3)2受热分解的化学方程式______________,通入O2的物质的量为_____________。
④小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。写一点不足之处:__________________________。
查看答案和解析>>
科目: 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:填空题
[化学—选修2:化学与技术]
工业炼铜的方法有由黄铜矿(主要成分是CuFeS2,杂质不含铜元素)炼制精铜的工艺流程示意图如图:
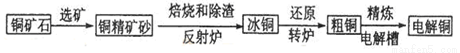
(1).黄铜矿中铜的质量分数为0.4,生产1吨纯铜理论上需要这种黄铜矿____________吨。
(2).在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,_____________________。且部分Fe的硫化物转变为Fe的低价氧化物。
(3).从环保环境和充分利于原料角度看如何处理和利用产生的烟气?___________。
(4).在转炉中,冰铜中的Cu2S先被氧化成Cu2O,,生成的Cu2O再与Cu2S反应,两步反应的热化学方程式为:①2Cu2S(s)+3O2(g)═2Cu2O(s))+2SO2(g)△H=-768.2kJ.mol-1
②2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ.mol-1
则反应Cu2S转化为铜的热化学方程式:_________________________。
将3molCu2S与一定量的空气(氮气、氧气的体积比为4:1)在密闭容器中充分反应(假设各步反应都完全且Cu2S完全参与反应),得到单质铜3mol,所得气体中SO2的体积分数为_____________。
(5).电解精炼铜,电解质溶液为______________,电解一段时间后,电解质溶液的浓度_____________(填“减少”、“不变”、或“增大”)
(6).利于反应Cu+H2O2+H2SO4=CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为__________________。
查看答案和解析>>
科目: 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:推断题
[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3

查看答案和解析>>
科目: 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:推断题
[化学—选修5:有机化学基础]
化合物X是一种香料,按图所示的路线合成,请回答:

已知: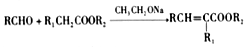
(1).烃A的结构简式是_______________,生成B的反应类型是_______________。
(2).F中所含官能团的名称是____________,已知F能与新制Cu(OH)2悬浊液反应,请写出化学方程式:____________________。
(3).D→E的反应类型是_________,E+C→G的化学方程式:___________________。
(4).对于化合物X,下列说法正确的是___________(填序号)。
A.0.1molX充分燃烧约消耗224L空气(标况)
B.X苯环上的一氯代物有三种
C.X可使Br2的CCl4溶液和KmnO4(H+)溶液褪色,且原理相同
D.X在酸性条件下的水解产物均可与C2H5OH反应
⑸.与G含有相同官能团,且苯环上只有一个取代基的同分异构体有____________种,W为其中一种,具有下列结构特征:A.能发生银镜反应,B.核磁共振氢谱显示有五组峰,峰面积之比为6:2:2:1:1。写出W的结构简式:_____________________。
⑹.以甲苯和乙烯为起始原料,选用必要的无机试剂合成二苯甲酸乙二酯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目: 来源: 题型:填空题
| 阳极的离子 和电极反应式 | 阴极的离子 和电极反应式 | 电解总反应式 | 溶液浓度变化 | 溶液pH的变化 | |
| HCl | 2Cl--2e-=Cl2↑ | 2H++2e-=H2↑ | 2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑ | 减小 | 增大 |
| CuBr2 | 2Br--2e-=Br2 | Cu2++2e-=Cu | 2Br-+Cu2+$\frac{\underline{\;通电\;}}{\;}$Br2+Cu | 减小 | 增大 |
| KCl | 2Cl--2e-=Cl2↑ | 2H++2e-=H2↑ | 2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | 减小 | 增大 |
| CuSO4 | 4OH--4e-=O2↑+2H2O | Cu2++2e-=Cu | 2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | 减小 | 增大 |
| NaOH | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 增大 |
| H2SO4 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 减小 |
| KNO3 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 不变 |
| Na2SO4 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 品红溶液褪色 | B. | AgNO3溶液产生沉淀 | ||
| C. | BaCl2溶液产生沉淀 | D. | 石蕊试液变红 |
查看答案和解析>>
科目: 来源: 题型:解答题


 .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com