
科目: 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:选择题
已知反应 2SO2(g)+O2(g) 2SO3(g)△H<0,下列说法不正确的是( )
2SO3(g)△H<0,下列说法不正确的是( )
A.升高温度,正、逆反应速率均加快 B.增大压强,化学平衡正向移动
C.当气体总质量不变时,反应达平衡状态 D.充入O2,可提高SO2的转化率
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:选择题
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )
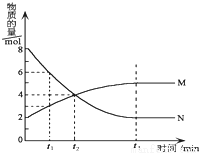
A.该反应的化学方程式为M═2N
B.若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1
C.t3时正反应速率等于逆反应速率
D.t2时正逆反应速率相等,反应达到平衡状态
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:选择题
下列关于化学平衡常数的说法中,正确的是( )
A.在任何条件下,化学平衡常数都是一个定值
B.当改变反应物的浓度时,化学平衡常数会发生改变
C.化学平衡常数K与温度、反应物浓度、体系的压强都有关
D.化学平衡常数K可以推断一个可逆反应进行的程度
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:选择题
可逆反应mA(固)+nB(气)?cC(气)+fD(气)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示,下列叙述正确的是( )
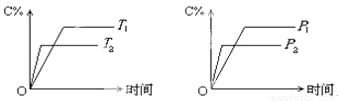
A.化学方程式中n>c+f
B.达到平衡后,若使温度升高 ,化学平衡向逆反应方向移动
C.达到平衡后,若使用催化剂,C的体积分数增大
D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:选择题
现有X(g)+Y(g)?2Z (g),正反应放热,从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2→t3的曲线变化是由哪种条件引起的( )
(g),正反应放热,从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2→t3的曲线变化是由哪种条件引起的( )
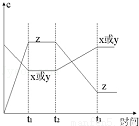
A.增大X或Y的浓度 B.增大压强
C.增大Z的浓度 D.升高温度
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:选择题
在密闭体积不变的真空容器中加入一定量纯净的氨基甲酸铵固体(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g),已知25℃时,平衡气体总浓度为2.4×10-3mol·L-1,下列说法中正确的是( )
2NH3(g)+CO2(g),已知25℃时,平衡气体总浓度为2.4×10-3mol·L-1,下列说法中正确的是( )
A.密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态
B.20℃时氨基甲酸铵的分解平衡常数为2.048×10-9mol3·L-3
C.恒温下压缩体积,NH3的体积分数不变
D.再加入一定量氨基 甲酸铵,可加快正反应反应速率
甲酸铵,可加快正反应反应速率
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:填空题
(1)在与外界隔离的体系中,自发过程将导致体系的熵 ,(填“增大”、“减小”、“不变”);对于同一种物质, 时熵值最大。(填“固态”、“液态”、“气态”)
(2)某工厂实验室用CO和H2制备CH3OH,其原理为:CO(g)+2H2(g)  CH3OH(g) △H < 0该温度下的化学平衡常数表达式_____________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)
CH3OH(g) △H < 0该温度下的化学平衡常数表达式_____________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)
(3)M与N是同素异形体,由M=N;△H=+119KJ/mol可知,M比N________(填稳定、不稳定)
(4)一定温度下,反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后, 保持压强不变,充入Ar,其正反应速率__________(A.变快 B.不变 C变慢,填字母代号);该反应向__________(填正移、逆移或不移)。
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:填空题
对于反应2A(g) + B(g)  2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
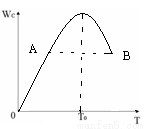
(1)T0对应的V正与V逆关系是V正___________V逆(填“>”、“<”、“=”)。
(2)A、B两点正反应速率的大小关系VA___________VB(填“>”、“<”、“=”)。
(3)温度T<T0时,Wc逐渐增大的原因是____________________;
(4)500℃条件下,该反应 K =2.33 ,测得某时刻,A(g)、B(g)、C(g)的浓度均为0.5mol/L,则此时v(正)____________v(逆)(填“>”“<”或“=”)
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:实验题
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaO H溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
H溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
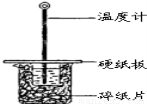
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;
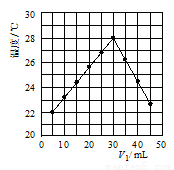
(4)若将V1mL1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
查看答案和解析>>
科目: 来源:2016-2017学年黑龙江大庆中学高二上期中化学试卷(解析版) 题型:填空题
甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料。
Ⅰ.制取氢气
已知:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.2kJ·mol-1
CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247.4kJ·mol-1
2CO(g)+2H2(g) △H=+247.4kJ·mol-1
(1)请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式___________________
(2)若将0.1mol CH4和0.1mol H2O(g)通入体积为10L的密闭容器里,在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
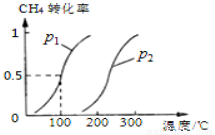
①已知1 00℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率_________;
00℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率_________;
②该反应的化学平衡常数___________________;
③图中的p1 p2(填“<”、“>”或“=”);
Ⅱ.制备甲醇
(3)在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g) △H<0。若容器容积不变,下列措施可增加甲醇产率的是________;
CH3OH(g) △H<0。若容器容积不变,下列措施可增加甲醇产率的是________;
A.升高温度
B.再充入1mol CO和3mol H2
C.将CH3OH(g)从体系中分离
D.充入He,使体系总压强增大
E.使用更高效的催化剂
Ⅲ.合成乙酸
(4)甲烷直接合成乙酸具有重要的理论意义和应用价值。光催化反应技术使用CH4和 (填化学式)直接合成乙酸,且符合“绿色化学”的要求(原子利用率100℅)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com