
科目: 来源:2016-2017学年甘肃省高二上期中理化学试卷(解析版) 题型:选择题
一定温度下,在一个容积为1 L的密闭容器中,充入1 mol H2(g)和1 mol I2(g),发生反应H2(g) + I2(g)  2 HI(g),经充分反应达到平衡后,HI(g)的气体体积分数为50%,在该温度下,在另一个容积为2L的密闭容器中充入1 mol HI(g)发生反应HI(g)
2 HI(g),经充分反应达到平衡后,HI(g)的气体体积分数为50%,在该温度下,在另一个容积为2L的密闭容器中充入1 mol HI(g)发生反应HI(g) 
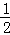 H2(g) +
H2(g) + 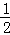 I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )
A.第二个反应的平衡常数为1
B.第二个反应的平衡常数为0.05
C.第二个反应达到平衡时,H2的平衡浓度为0.25 mol/L
D.第二个反应达到平衡时,HI(g)的平衡浓度为0.25 mol/L
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上期中理化学试卷(解析版) 题型:选择题
甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图所示。下列说法正确的是( )
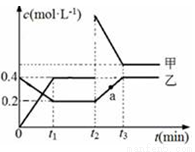
A.甲是N2O4
B.a点处于平衡状态
C.t1~t2时间内v正(乙)<v逆(甲)
D.反应进行到t2时刻,改变的条件可能是升高温度
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上期中理化学试卷(解析版) 题型:选择题
对于平衡体系m A(g)+n B(g) p C(g)+g D(g) ΔH < 0。下列结论中错误的是( )
p C(g)+g D(g) ΔH < 0。下列结论中错误的是( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n < p+q
B.若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的 要小
要小
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上期中理化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为1.0 L的恒容密闭容器中,充入一定量的H2和SO2发生下列反应:3 H2(g) + SO2(g) 2 H2O(g) + H2S(g),下列说法正确的是( )
2 H2O(g) + H2S(g),下列说法正确的是( )
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
H2 | SO2 | H2 | SO2 | ||
容器Ⅰ | 300 | 0.3 | 0.1 | 0.02 | |
容器Ⅱ | 300 | 0.6 | 0.2 | ||
容器Ⅲ | 240 | 0.3 | 0.1 | 0.01 | |
A.该反应正反应为吸热反应
B.容器Ⅲ达到平衡的时间比容器I短
C.240℃时,该反应的平衡常数为1.08×104
D.容器Ⅱ达到平衡时SO2的转化率比容器I小
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上期中理化学试卷(解析版) 题型:选择题
已知:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41 kJ/mol,相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41 kJ/mol,相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 吸收热量:Q |
下列说法中不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO反应速率等于H2O的反应速率
C.容器①中CO的转化率等于容器②中CO2的转化率
D.平衡时,容器①和②中CO2的浓度相等
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上期中理化学试卷(解析版) 题型:填空题
在水溶液中,橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈_______色,因为 。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈________色,因为________________。
(3)向原溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡________,溶液颜色将 。
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上期中理化学试卷(解析版) 题型:填空题
一定温度下,发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH,已知该反应在不同温度下的平衡常数如下表:
Fe(s)+CO2(g) ΔH,已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1100 |
平衡常数 | 0.68 | 0.50 |
请回答下列问题:
(1)该反应的ΔH 0
(2)T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为α1,c(CO2)=0.15mol•L-1,则温度T (填高于、低于、等于)1000,若此时保持其它条件不变再充入2.0 mol CO(g),再达平衡时测得CO转化α2,则α1 α2(填>、<或=)。
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上期中理化学试卷(解析版) 题型:填空题
一定温度下,在2 L的密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2 SO2(g)+O2(g)  2 SO3(g) ΔH < 0,n(O2)随时间的变化关系如图实线所示:
2 SO3(g) ΔH < 0,n(O2)随时间的变化关系如图实线所示:
(1)该温度下反应的平衡常数K为________,升高温度K值将________(填增大、不变或减小,下同)。
(2)若温度不变,在容器中再加1 mol O2,重新达到平衡,则SO2的平衡浓度将 ,氧气的转化率将 ,SO3的体积分数将 。
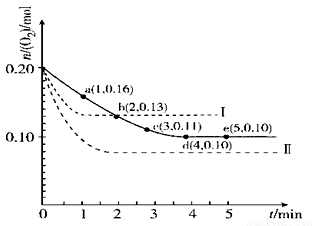
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是 ,曲线II改变的实验条件是 。
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上期中理化学试卷(解析版) 题型:填空题
合成氨工业在现代农业、国防工业中,有着重要的地位。已知:N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ·mol-1。
2NH3(g)ΔH=-92kJ·mol-1。
(1)下列有关该反应速率的叙述,正确的是 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)该反应的化学平衡常数表达式为K=_________________。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (用分数表示)。
(4)对于合成氨反应而言,下列有关图像一定正确的是_____________。
a. b.
b. c.
c.
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上期中理化学试卷(解析版) 题型:填空题
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6 FeO(s) + CO2(g) = 2 Fe3O4(s) + C(s) ΔH=-76.0 kJ/mol,该反应中每放出38 kJ热量,转移电子的物质的量为 mol。
(2)在一定条 件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)
件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g)ΔH<0
CH4(g)+2H2O(g)ΔH<0
①向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol/L,H2 0.8 mol/L, CH4 0.8 mol/L,H2O 1.6 mol/L,起始充CO2和H2的物质的量分别为 、 ,CO2的平衡转化率为 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 mol CO2和4 mol H2,在II中充入1 mol CH4和2 mol H2O(g),300℃下开始反应。达到平衡时,下列说法正确的是 。
A.容器I、II中正反应速率相同
B.容器I、II中CH4的物质的量分数相同
C.容器I中CO2的物质的量比容器II中的多
D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com