
科目: 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:选择题
已知:2SO2(g)+O2(g) 2SO3△H<0。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
2SO3△H<0。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
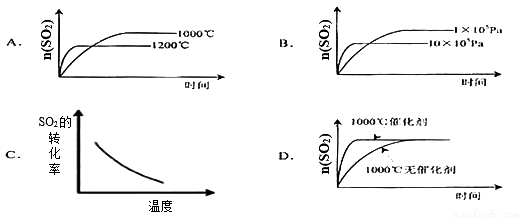
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:选择题
对于反应2NO2(g) N2O4(g) ΔH<0,在一定条件下达到平衡,欲使NO2转化率增大,应采取的措施是
N2O4(g) ΔH<0,在一定条件下达到平衡,欲使NO2转化率增大,应采取的措施是
①容器体积不变,再充入NO2
②容器体积不变,再充入N2O4
③使体积增大到原来的2倍
④升高温度
A.① B.②③ C.①② D.③④
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:选择题
0.2mol 气态燃料B2H6在氧气中燃烧,生成固态三氧化二硼和气态水,放出406.6 kJ的热量,又知:H2O (l) == H2O(g)△H = +44 kJ·mol-1,则B2H6的燃烧热为
A.2165 kJ·mol-1 B.2033 kJ·mol-1 C.406.6 kJ·mol-1 D.2077 kJ·mol-1
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:选择题
某温度下,反应SO2(g) + 1/2O2(g)  SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)  2SO2(g) + O2(g)的平衡常数K2的值为
2SO2(g) + O2(g)的平衡常数K2的值为
A.2500 B.100 C.4×10-4 D.2×10-2
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:选择题
在一定温度下,反应H2(g)+ X2(g) 2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A.5% B.17% C.25% D.33%
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:选择题
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表,v 的单位为(mmol·L-1·min-1)。下列判断错误的是
c(mol·L-1) T / K | 0.600 | 0.500 | 0.400 | 0.300 |
318.2 | 3.60 | 3.00 | a | 1.80 |
328.2 | 9.00 | 7.50 | 6.00 | 4.50 |
b | 2.16 | 1.80 | 1.44 | 1.08 |
A.318.2K,蔗糖起始浓度为0.400 mol·L-1,10min后蔗糖浓度略大于 0.376 mol·L-1
0.376 mol·L-1
B.b K时,若蔗糖的浓度为0.35 mol·L-1,则v = 1.26 mmol·L-1·min-1[
C.b < 318.2
D.若同时改变反应温度和蔗糖的浓度,则v肯定变化
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:选择题
某温度下,在2 L的密闭容器中,加入1mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g) 3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45mol·L-1
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:选择题
在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.该反应的ΔH>0、ΔS<0
B.体系的总压强p:p(Ⅰ)>p(Ⅲ)
C.平衡常数:K(Ⅰ)>K(Ⅱ)
D.T1K时,Ⅳ点所处的状态中v(正)<v(逆)
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:实验题
碘在科研与生活中有重要作用,某兴趣小组用0.20 mol/L KI、0.4%淀粉溶液、0.20 mol/L K2S2O8、0.010 mol/L Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-=2SO42-+I2(慢);I2+2S2O32-=2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物 质的量需满足的关系为:n(S2O82-):n(S2O32-) 。
质的量需满足的关系为:n(S2O82-):n(S2O32-) 。
(2)如果实验中不使用Na2S2O3溶液,可能存在的不足是 。
(3)为探究反应物浓度对化学反 应速率的影响,设计的实验方案如下表:
应速率的影响,设计的实验方案如下表:
实验 序号 | 试剂体积 V / mL | 显色时间 t /s | ||||
K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 | ||
① | 10 | 10 | 0 | 4 | 1 | 26.8 |
② | 5 | 10 | 5 | 4 | 1 | 54.0 |
③ | 2.5 | 10 | V1 | 4 | 1 | 108.2 |
④ | 10 | 5 | 5 | 4 | 1 | 53.8 |
⑤ | 5 | 7.5 | 7.5 | 4 | V2 | t1 |
表中V1 = mL,理由是 ;V2 = mL,理由是 。显色时间t1大约是 。
(4)根据表中数据可以得出的结论是 。
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:实验题
为探讨浓度对化学平衡的影响,某同学对可逆反应 “2Fe3++2I- 2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。
2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。

说明:0.005 mo l·L-1的Fe2(SO4)3溶液颜色接近于无色。
l·L-1的Fe2(SO4)3溶液颜色接近于无色。
(1)实验中要待实验Ⅰ溶液颜色不再改变时,才能进行实验Ⅱ,目的是 。
(2)实验Ⅱ中,ⅰ的现象是 ,该实验证明 。
(3)实验Ⅱ中,ⅲ的化学平衡向 移动(填“正反应方向”或“逆反应方向”);ⅲ的现象是溶液变浅,该现象 (填“能”或“不能”)说明化学平衡发生移动。如果前一空填“能”,则下一空不填;如果前一空填“不能”,则ⅲ的目的是 。
(4)实验Ⅱ中,ⅱ的现象是 ,即能证明增大生成物浓度化学平衡发生了逆向移动。
(5)除了上图中的方法外,若要使该可逆反应的化学平衡逆向移动,还可以采用的方法有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com