
科目: 来源:2016-2017学年甘肃省高二上10月学段考理化学卷(解析版) 题型:选择题
对于可逆反应:mA(g)+nB(g) xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )
xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )

A.△H > 0,m + n > x B.△H > 0,m + n < x
C.△H < 0,m + n < x D.△H < 0,m + n > x
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上10月学段考理化学卷(解析版) 题型:选择题
根据以下三个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-Q1 kJ/mol
2H2S(g)+O2 (g)=2S(s)+2H2O(l) ΔH=-Q2 kJ/mol
2H2S(g)+O2 (g)=2S(s)+2H2O(g) ΔH=-Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1> Q2 > Q3 B.Q1> Q3 > Q2 C.Q3 > Q2 > Q1 D.Q2 > Q1> Q3
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上10月学段考理化学卷(解析版) 题型:选择题
在一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)  Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
A.若增大压强,则物质Y的转化率减小
B.以X浓度变化表示的反应速率为0.001mol/(L•s)
C.若升高温度,X的体积分数增大,则该反应的ΔH>0
D.将容器体积变为20L,Z的平衡浓度变为原来的1/2
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上10月学段考理化学卷(解析版) 题型:选择题
如图所示,反应2SO2(g)+O2(g) 2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积
2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积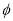 (SO3)随温度变化的曲线应为 ( )
(SO3)随温度变化的曲线应为 ( )
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上10月学段考理化学卷(解析版) 题型:选择题
在密闭容器中发生如下反应:mA(g)+nB(g) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是( )
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是( )
A. m+n<p B. 平衡向逆反应方向移动
C. A的转化率降低 D. C的体积分数增加
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上10月学段考理化学卷(解析版) 题型:选择题
下列变化过程能用勒夏特列原理解释的是 ( )
A.工业合成氨中选择高温条件下进行
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO2的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上10月学段考理化学卷(解析版) 题型:选择题
可逆反应A(g)+B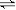 C(g)+D达到平衡时,下列说法不正确的是( )
C(g)+D达到平衡时,下列说法不正确的是( )
A.若增大A的浓度,平衡体系颜色加深,D不一定是具有颜色的气体
B. 升高温度,C的百分含量减小,说明正反应是放热反应
C.增大压强,平衡不移动,说明B、D必是气体
D.若B是气体,增大A的浓度会使B的转化率增大
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上10月学段考理化学卷(解析版) 题型:填空题
(1)250C、101kPa时,____________纯物质完全燃烧生成__________时所放出的热量,叫做该物质的燃烧热。
(2)已知:①P4(s,白磷)+5O2(g)=P4O10(s)△H=—2983.2kJ•mol-1
②P(s,红磷)+5/4O2(g)=1/4P4O10(s)△H=—738.5kJ•mol-1
写出白磷转化为红磷的热化学方程式: __。
(3)已知:①Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g)△H1=-26.7kJ/mol
②3Fe2O3(s)+CO(g)==2Fe3O4(s)+CO2(g)△H2=-50.75kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H3=-36.5kJ/mol
计算反应:2FeO(s)+2CO(g)==2Fe(s)+2CO2(g)的△H =_ __
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上10月学段考理化学卷(解析版) 题型:填空题
可逆反应:aA(g)+bB(g) cC(g)+dD(g)△H 有下列两图所示变化:
cC(g)+dD(g)△H 有下列两图所示变化:

试根据上图回答:
(1)压强P1 P2(填﹥、=、﹤,下同)
(2)(a+b) (c+d)
(3)温度t1℃ t2℃
(4)△H 0
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上10月学段考理化学卷(解析版) 题型:填空题
在2L恒容密闭容器内,800℃时反应:2NO(g)+O2(g)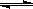 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
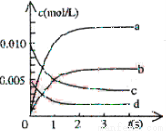 (1)写出该反应的平衡常数表达式:K= 。
(1)写出该反应的平衡常数表达式:K= 。
已知: >
> ,则该反应是 热反应。
,则该反应是 热反应。
(2)图中表示NO2浓度的变化的曲线是 。
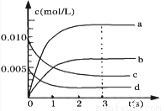
用O2表示从0—2s内该反应的平均速率υ(O2)= 。
(3)能说明该反应已达到平衡状态的是 。
a.C(NO2)=2C(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4) 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com