
科目: 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:选择题
关于下列各实验装置的叙述中,错误的是
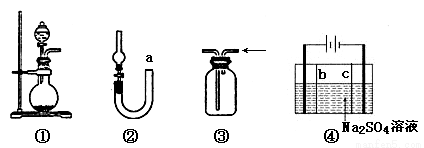
A.装置①可用于实验室制取少量NH3或O2
B.可用从a处加水的方法检验装置②的气密性
C.实验室 可用装置③收集H2、NH3
可用装置③收集H2、NH3
D.利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
查看答案和解析>>
科目: 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:选择题
一定条件下,碳钢腐蚀与溶液pH的关系如下表,下列说法错误的 是
是
pH | 2 | 4 | 6 | 6.5 | 8 |
腐蚀快慢 | 较快 | 慢 | 较快 | ||
主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2— |
A.在pH<4的溶液中,碳钢主要发生析氢腐蚀
B.在pH>6的溶液中,碳钢主要发生吸氧腐蚀
C.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢
D.在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4H++4e—═2H2O
查看答案和解析>>
科目: 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:选择题
常温下,有关0.1 mol·L—1氨水的叙述正确的是
A.该溶液中氢离子的浓度:c(H+)=1×10—11 mol·L—1
B.0.1 mol·L—1氨水与0.1 mol·L—1 HCl溶液等体积混合后所得溶液中:
c(NH4+)+c(H+)=c(Cl—)+c(OH—)
C.0.1 mol·L—1的氨水与0.05 mol·L—1 H2SO4等体积混合后所得溶液中:
c(NH4+)+c(NH3·H2O)=0.1 mol·L—1
D.已知浓度均为0.1mol·L—1的NH3·H2O和NH4Cl溶液等体积混合后溶液呈碱性,则:
c(NH4+)>c(NH3·H2O)>c(Cl—)>c(OH—)>c(H+)
查看答案和解析>>
科目: 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:选择题
设NA为 阿伏加德罗常数的值,下列说法正确的是
阿伏加德罗常数的值,下列说法正确的是
A.1L lmol·L—1 FeBr2溶液与l molCl2气反应时转移的电子数目为3NA
B.7g分子式为CnH2n的链烃中含有的C—H键的数目为NA
C.常温时,1.0L pH=13的Ba(OH)2溶液中含有OH—的数目为0.2NA
D.0.5mol·L—1硫酸钠溶液中含有溶质离子总数为1.5NA
查看答案和解析>>
科目: 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:选择题
有关下列图像的分析正确的是
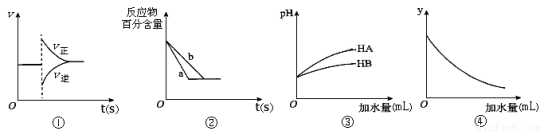
A.图①表示在N2(g)+3H2(g) 2NH3(g)达到平衡后,减少NH3浓度时速率的变化
2NH3(g)达到平衡后,减少NH3浓度时速率的变化
B.图②中a、b曲线分别表示反应H2(g)十I2(g) 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
C.图③说明HA是比HB更弱的酸
D.图④中的y可表示将冰醋酸加水稀释时溶液导电能力的变化情况
查看答案和解析>>
科目: 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:推断题
下表为元素周期表中的一部分,

回答下列问题:
(1)画出③元素的原子结构示意图 ;在④⑤⑥三种元素中,原子半径最大的是 (用元素符号表示);⑦元素在周期表中的位置是 。
(2)④的单质在③的单质中燃烧生成甲,甲中化学键的类型为 。
(3)写出⑥的最高价氧化物与④的最高价氧化物对应水化物反应的离子方程式 。
(4)②的最简单气态氢化物与其最高价含氧酸可发生化合反应生成乙,用离子方程式表示乙的水溶液显酸性的原因 。
(5)丙是⑤的最高价氧化物对应的水化物,难溶于水。在298K时,丙的Ksp=5.6×10—12,则pH=13.0的丙的饱和溶液中,⑤离子的物质的量浓度为 。
(6)向含元素⑦的某硫酸盐(丁)溶液中加入足量的浓NaOH溶液,生成无色有刺激性气味的气体,同时产生白色沉淀,很快变成灰绿色,最后变成红褐色。写出丁的化学式 。
查看答案和解析>>
科目: 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:实验题
在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率。某研究小组用下图装置模拟生产过程中测定SO2转化成SO3的转化率。已知SO3的熔点是16.8℃,沸点是44.8℃。发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2↑+H2O
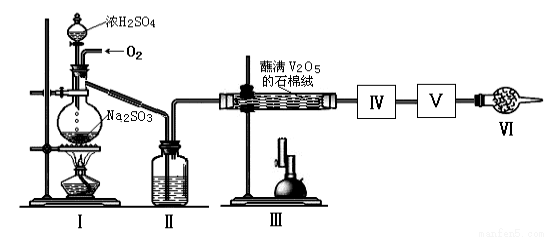
(1)Ⅱ中的试剂是 ,仪器Ⅵ的名称为 。
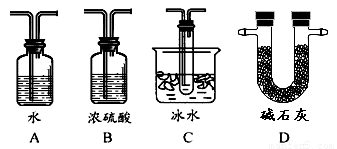
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置。请从下图A~D装置中选择最适合装置并将序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是 、 。
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先_______后_________(填编号)。
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是 。
(5)用18.9gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了7.2g,则实验测得SO2的转化率为 。
查看答案和解析>>
科目: 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:填空题
硫是一种重要的非金属元素,在自然界中以游离态和多种化合态形式存在。其中二氧化硫是主要的大气污染物之一。完成下列填空:
(1)依据平衡移动原理,用化学用语解释将SO2通入CaCO3悬浊液使之变澄清的原因 。
(2)火法炼铜中有如下反应:
Ⅰ:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH=-768.2kJ·mol—1
Ⅱ:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) ΔH=+116.0kJ·mol—1
①在反应Ⅱ中,只作氧化剂的是 (用化学 式表示)。
式表示)。
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的ΔH= 。
(3)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,配平下列反应式:
Mn2++ S2O82―+ H2O = MnO4―+ SO42―+ H+
(4)将SO2通入氯酸溶液中生成一种强酸和一种氧化物,已知反应掉1.5mol氯酸时转移了9.03×1023个电子,写出该反应的化学方程式 。
查看答案和解析>>
科目: 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:填空题
某实验小组研究可逆反应AsO43—+2I—+2H+ AsO33—+I2+H2O时,设计了如图所示的原电池:
AsO33—+I2+H2O时,设计了如图所示的原电池:
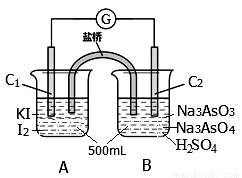
(1)电池工作时,盐桥中的阴离子向 极移动(填C1或C2);若向B池里滴加NaOH溶液,平衡向 方向移动,此时C2极的电极反应式为 。
(2)下 列判断正确的是 。
列判断正确的是 。
a.微安表指针为0时,该反应处于平衡状态。
b.向A池中加入淀粉溶液,溶液变蓝说明该反应处于平衡状态。
c.AsO43—、AsO33—离子浓度相等时,该反应处于平衡状态。
(3)若在5min时间内电路中通过了1.204×104库伦电量,用I—浓度的变化来表示的化学反应速率为 。
(4)该反应的平衡常数表达式K= 。若升高温度,K值增大,则正反应的△H 0。(填“>”、“<”或“=”)
(5)已知反应达到平衡时,AsO43—离子转化率为25%,则I—离子的转化率 。
A.大于25% B.小于25% c.等于25% d无法确定
(6)反应达到平衡后,若将AsO43—、I—、H+、AsO33—、I2的浓度均减少到原来的一半,上述平衡向 方向移动。
查看答案和解析>>
科目: 来源:2017届吉林省高三上第二次月考化学试卷(解析版) 题型:选择题
下列做法正确的是( )
A.将浓硝酸保存在无色玻璃瓶中
B.金属钠和钾保存在煤油中
C.Na2CO3可以保存在玻璃塞的玻璃瓶中
D.NaOH固体放在滤纸上称量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com