
科目: 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:选择题
在体积不变的绝热密闭容器中,2molSO2与1molO2在催化剂作用下发生反应:2SO2(g) + O2(g)  2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
A、增大氧气浓度,平衡正向移动,平衡常数不变
B、降低温度,正反应速率比逆反应速率减小的程度小
C、平衡时SO2气体的转化率为50%
D、该条件下反应放出0.5QkJ的热量
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:选择题
已知反应:2NO2 (红棕色) N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )

A、b点的操作是压缩注射器
B、c点与a点相比,c(NO2)增大,c(N2O4)减小
C、d 点:v(正)>v(逆)
D、若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:选择题
在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)? xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4。下列判断不正确的是( )
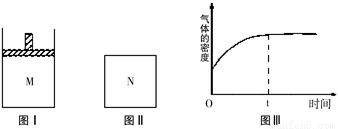
A、x=2
B、若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C、A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D、若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:实验题
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是 (填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
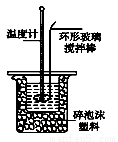
(3)写出该中和反应的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
上表中的温度差平均值为 ℃
近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③ 上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:填空题
关于N2(g)+3H2(g) 2NH3(g) △H1KJ/mol,满足如下图像:
2NH3(g) △H1KJ/mol,满足如下图像:
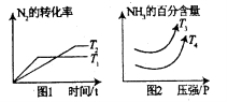
(1)根据图判断△H1 0,T3 T4。(填“>”“<”“=”)
(2)若温度为T1且容器为2L的密闭容器下中,发生合成氨的反应,起始时通入2mol的N2和6mol的H2,10分钟达到平衡状态,此时NH3的体积分数为60%。则0到10min内用H2表示化学反应速率为_________mol/(L·min),N2的转化率为___________,反应开始和平衡状态体系的压强之比等于___________。
(3)若第(2)小问中反应体系达到平衡后,再通入1molN2和3mol的H2,则H2的转化率为___________(填“增大”“减小”或“不变”)
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:填空题
I.“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) △H=+131.4kJ/mol
CO(g)+H2(g) △H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为 。
(2)关于上述反应在化学平衡状态时的描述正确的是 .
A.CO的含量保持不变 B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:

①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇(化学式为CH3OH),CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式 。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡常数表达式为: ,它所对应的化学方程式为 。
,它所对应的化学方程式为 。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A、缩小体积增大压强 B、升高温度 C、加催化剂 D、使氨气液化移走
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:填空题
在一个2L的密闭容器中投入反应物,发生反应2SO3(g) 2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
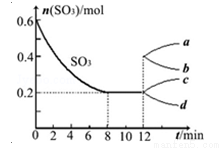
(1)根据8min时到达平衡,算出该反应的平衡常数值为 。
(2)用O2表示0到8min内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A、v(SO3)=2v(O2)
B、容器内压强保持不变
C、v(SO2)逆=2v(O2)正
D、容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为 。
A、a B、b C、c D、d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向 反应方向移动(填“正”或“逆”)。SO3的体积分数 (填“增大”或“减小”)。
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高一上期中化学试卷(解析版) 题型:选择题
根据所给的信息和标志,判断下列说法错误的是( )
A | B | C | D |
《神农本草经》记载,麻黄能“止咳逆上气” | 碳酸氢钠药片 |
|
|
古代中国人已用麻黄治疗咳嗽 | 该药是抗酸药,服用时喝些醋能提高药效 | 看到有该标志的丢弃物,应远离并报警 | 贴有该标志的物品是可回收物 |
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高一上期中化学试卷(解析版) 题型:选择题
判断下列有关化学基本概念的依据正确的是 ( )
A.酸:阳离子全部为H+
B.纯净物与混合物:是否仅含有一种元素
C.强弱电解质:溶液的导电能力大小
D.溶液与胶体:本质区别是能否发生丁达尔效应
查看答案和解析>>
科目: 来源:2016-2017学年安徽省高一上期中化学试卷(解析版) 题型:选择题
下列各组物质中,可按溶解、过滤、蒸发结晶的操作顺序分离的是( )
A.CaO和KCl B.CuO和NaCl C.BaSO4和CaCO3 D.NaCl和AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com