
科目: 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:选择题
下列叙述I和II均正确并有因果关系的是
选项 | 叙述I | 叙述II |
A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
C | SO2具有漂白性 | SO2能使酸性KMnO4溶液褪色 |
D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO溶液制备HClO |
查看答案和解析>>
科目: 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:选择题
某混合物含有氯化钠、碳酸钠和氯化钾。经分析知其中氯的质量分数为35.5%,则该混合物中碳酸钠的质量分数可能为
A. 20% B.30% C.45% D.55%
查看答案和解析>>
科目: 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:选择题
含有a mol FeBr2的溶液中,通入 x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2++Cl2==2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2==Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2==Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2==2Br2+2Fe3++6Cl-
查看答案和解析>>
科目: 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:选择题
a g 下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a的选项有
A.CH3COOCH2CH3 B. HCHO C.HOOCCOOH D.HCOOH
查看答案和解析>>
科目: 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:选择题
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是

A.相对于途径①,途径②更好地体现了绿色化学思想
B.Y可以是葡萄糖溶液
C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
D.将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体
查看答案和解析>>
科目: 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:选择题
向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是
A.Fe2O3与FeO的物质的量之比为1∶6
B.硝酸的物质的量浓度为3.0 mol/L
C.产生的NO在标准状况下的体积为4.48 L
D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol
查看答案和解析>>
科目: 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:推断题
X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为___________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_________________。
(3)YX4M的电子式为___________,Q3Y2与水可剧烈反应,反应的化学方程式为____________
(4)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为___________。
查看答案和解析>>
科目: 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:实验题
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案
方案一 滴定法:用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式 。
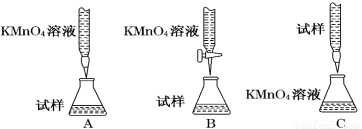
(2)某同学设计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)
(3)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管、玻璃棒外,还需 (填仪器名称)。在溶液配制过程中,下列操作会导致配制结果偏低的是___________(填写代号)。
a.定容时,俯视容量瓶刻度线
b.容量瓶在使用前内有少量蒸馏水
c.转移溶液后的烧杯、玻璃棒未洗涤
d.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
A.浓盐酸 B.稀硫酸 C.稀硝酸 D.浓硫酸
方案二 称量法:操作流程如下:
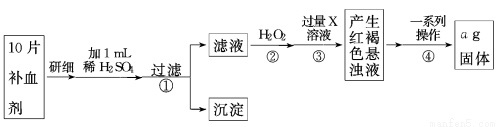
(5)写出步骤②中H2O2氧化Fe2+ 的离子方程式 。步骤②中除用H2O2外还可以使用的物质是 ,步骤②是否可以省略 ,理由是 。
(6)步骤④一系列操作依次是:过滤、洗涤、 、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目: 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:填空题
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有__________性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1 mol Cl2参与反应时 释放145 kJ的热量,写出这个反应的热化学方程式:________________。
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检 测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O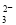 +I2=S4O
+I2=S4O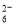 +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:
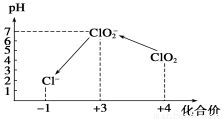
请回答:
①操作Ⅰ中反应的离子方程式是___________________。
②确定操作Ⅱ完全反应的现象是___________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是___________________。
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol·L-1的Na2S2O3溶液10mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
科目: 来源:2017届辽宁省瓦房店市高三上10月月考化学试卷(解析版) 题型:实验题
亚硝酸钠常用作食品防腐剂。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸的反应及生成气体产物的成分。
已知:①NO+NO2+2OH-===2NO +H2O
+H2O
②气体液化的温度:NO2:21℃、NO:-152℃
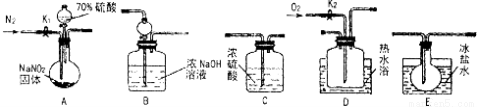
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接):
(2)组装好仪器后,接下来进行的操作是 .
(3)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体中含有NO,依据的现象是___________________。
②装置B的作用是___________________,装置E的作用是____________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com