
科目: 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:填空题
(1)已知常温下,Ksp[Fe(OH)3]=4.0×10-38, 在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:____________;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为_________mol•L-1
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的PH如下表
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是__________。根据表中数据,浓度均为0.01 mol•L-1的下列四种酸的溶液分别稀释100倍,PH变化最大的是___________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3) 下列说法不正确的是___ ___ ___ (填序号)
A.某温度下纯水中的c(H+)=10-6,故显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下,PH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:实验题
为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0g试样,加水溶解,配成250mL试样溶液。
②用酸式滴定管量取25.00mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500mol/LNaOH溶液滴定,消耗NaOH溶液20.00mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 。
(3)完成并配平下列离子方程式: C2O42-+ MnO4-+ H+= CO2↑+ Mn2++
(4)步骤③中判断滴定终点的方法是 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)试样中H2C2O4·2H2O的质量分数为 。
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
下列电离方程式书写正确的是
A.CH3COOH H++CH3COO-
H++CH3COO-
B.NaHSO4 Na++H++SO42-
Na++H++SO42-
C.H2CO3 2H++CO32-
2H++CO32-
D.NaHCO3 Na++HCO3-
Na++HCO3-
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
在一定温度下的定密闭容器中发生反应H2(g)+I2(g)  2HI(g), 下列说法能说明此反应已经达到平衡状态的是
2HI(g), 下列说法能说明此反应已经达到平衡状态的是
A.容器内每减少1mol I2,同时生产2mol HI
B.容器内气体压强不再变化
C.混合气体的颜色不再变化
D.混合气体的密度恒定不变
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.第二次平衡时,Z的浓度为0.4 mol·L -1
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.m=2
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
对于可逆反应3H2(g)+N2(g) 2NH3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
2NH3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A.增大压强 B.降低温度 C.使用高效催化剂 D.充入更多N2
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合图的是

A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O ΔH<0
CO(NH2)2(s)+H2O ΔH<0
B.CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
C.CH3CH2OH(g) CH2=CH2(g)+H2O(g) ΔH>0
CH2=CH2(g)+H2O(g) ΔH>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH=CH2(g)+2H2O(g) ΔH<0
2C6H5CH=CH2(g)+2H2O(g) ΔH<0
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn), 发生反应:Sn(s)+Pb2+(aq)  Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
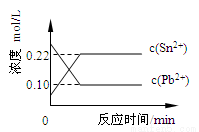
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
下列事实不能用化学平衡移动原理解释的是
A.光照新制的氯水时。溶液的PH逐渐减少
B.增大压强,有利于SO2和O2反应生成SO3
C.可向浓氨水加入氢氧化钠固体快速制取氨
D.500℃左右比常温下更有利于合成氨
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
在一定温度下,10mL 0.40mol·L-1H2O2溶液发生催化反应分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol﹒L-1﹒min-1
B.6~10min的平均反应速率:v(H202)<3.3×10-2mol﹒L-1min-1
C.反应至6min时,c(H2O2)=0.30mol﹒L-1
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com