
科目: 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A. 第一电离能:X一定大于Y
B. 气态氢化物的稳定性:HmY大于HnX
C. 最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性
D. X和Y形成化合物时,X显负价,Y显正价
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
已知热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH1=-483.6kJ/mol
则对于热化学方程式:2H2O(l)===2H2(g)+O2(g)ΔH2=QkJ/mol
下列说法正确的是
A.热化学方程式中化学计量数表示分子个数 B.Q = 483.6
C.Q > 483.6 D.Q < 483.6
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是
A.已知HCl和NaOH反应的中和热ΔH =-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热ΔH =-2×57.3 kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的ΔH = +(2×28 3.0)kJ·mol-1
3.0)kJ·mol-1
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g);ΔH <0的化学反应下列叙述不正确的是

A.反应过程中能量关系可用如图表示
B.若将该反应设计成原电池锌为负极
C.ΔH的值与反应方程式的计量系数无关
D.若将其设计为原电池当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:填空题
(1)用Cl2生产某些含氯有机物时会产生副产物HCl。
利用反应A可实现氯的循环利用。反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

①写出此条件下,反应A的热化学方程式 。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
(2)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻对应的实验条件改变分别是t4 ;t5 ;t7 。

②温度为T℃时,将2nmolH2和nmolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则n= 。
(3)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“氢氧化钠”或“硫酸”)。
(4)传统制备肼的方法是以NaClO氧化NH3,制得肼(N2H4)的稀 溶液。该反应的
溶液。该反应的 离子方程式是 。
离子方程式是 。
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:填空题
利用太阳能热化学硫碘循环分解水制氢反应过程如下图所示:
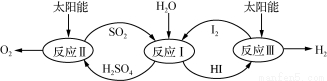
(1) 反应Ⅱ中涉及的热化学方程式为:
①H2SO4(l)=SO3(g)+H2O(g) ΔH=+177.3 kJ·mol-1
②2SO3(g) = 2SO2(g)+O2(g) ΔH=a kJ·mol-1
③2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550.2 kJ·mol-1则 a= ;
(2)反应Ⅰ得到的产物可用I2进行分离。该产物的溶液在过量I2的存在下会分成两层 :含低浓度I2的H2SO4溶液层和高浓度的I2的HI溶液层。
①区分两层溶液可加入的试剂为 (填化学式)。
②下列说法正确的是 (填序号)。
A. SO2在反应Ⅰ中作氧化剂
B. 加过量I2前,H2SO4溶液和HI不互溶
C. 两层溶液的密度存在差异
D. I2在HI溶液中比在H2SO4溶液中易溶
(3)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如右图所示。
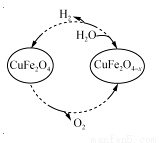
①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为 。
②若x=0.15,则1 mol CuFe2O4参与该循环过程理论上一次能制得标准状况下的H2体积为 L。
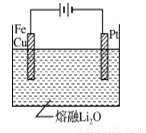
③CuFe2O4可用电化学方法得到,其原理如图所示, 则阳极的电极反应式为 。
则阳极的电极反应式为 。
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:填空题
原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子, W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
(1)W基态原子的价电子排布式为 。元素X、Y、Z的第一电离能由小到大顺序是 (填元素符号)。
(2)与XYZ-互为等电子体的一种分子为 (填化学式)。
(3)1 mol H2XZ3分子中含有σ键的数目为 。
(4)YH3极易 溶于水的主要原因是 。
溶于水的主要原因是 。
(5)尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
①尿素分子中C、N原子的杂化方式分别是 。
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 。根据价层电子对互斥理论推测NO3—的空间构型为 。

(6)CO2和NH3是制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。
查看答案和解析>>
科目: 来源:2016-2017学年江西省高一上月考二化学卷(解析版) 题型:选择题
下列叙述正确的是
A.1mol H2O2的质量为34g·mol-1
B.C2H5OH的摩尔质量为46g
C.3.01×1023个SO2分子的质量为32g
D.1 mol 任何物质均含有6.02×1023个分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com