
科目: 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:选择题
在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L,此反应符合下面图像,下列叙述正确的是
R(g)+2L,此反应符合下面图像,下列叙述正确的是
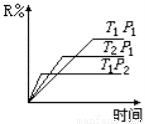
A.正反应放热,L是固体或液体
B.正反应放热,L是气体
C.正反应吸热, L是固体
D.正反应吸热,L是气体
查看答案和解析>>
科目: 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:选择题
下列热化学方程式正确的是
A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2 O(g)ΔH=-890.3kJ·mol-1
O(g)ΔH=-890.3kJ·mol-1
B.已知:H2(g)+1/2O2(g)=H2O(g)⊿H=—Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)⊿H=—2Q1kJ/mol
C.已知1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,其热化学方程式为N2H4(l)+2H2O2(l)===N2(g)+4H2O(g)ΔH=-641.6kJ·mol-1
D.已知:强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)ΔH=-114.6kJ/mo
查看答案和解析>>
科目: 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:选择题
在密闭容器中发生如下反应:mA(g)+nB(g) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
A.m+n>p
B.平衡向逆反应方向移动
C.A的转化率降低
D.C的体积分数减小
查看答案和解析>>
科目: 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:选择题
 反应A(g)+B(g)→C(g)ΔH,分两步进行:①A(g)+B(g)→X(g)ΔH1,②X(g)→C(g)ΔH2,反应过程中能量变化如图所示,E1表示A(g
反应A(g)+B(g)→C(g)ΔH,分两步进行:①A(g)+B(g)→X(g)ΔH1,②X(g)→C(g)ΔH2,反应过程中能量变化如图所示,E1表示A(g )+B(g)
)+B(g) →X(g)的活化能,下列说法正确的是
→X(g)的活化能,下列说法正确的是
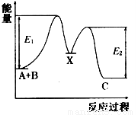
A.ΔH=E1-E2
B.E1是反应①的活化能
C.X是反应A(g)+B(g)→C(g)的催化剂
D.ΔH2>0
查看答案和解析>>
科目: 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:选择题
mA(s)+nB(g) qC(g);ΔH<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述正确的是
qC(g);ΔH<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述正确的是
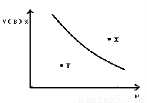
A、m+n<qB、X点时的状态,V正>V逆
C、n<qD、X点比Y点混和物的正反应速率慢
查看答案和解析>>
科目: 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:选择题
向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。附图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3~t4阶段为使用催化剂。下列说法正确的是
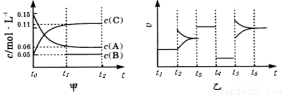
A.该反应一定是放热反应
B.t4~t5阶段改变的条件为减小压强
C.B的起始物质的量为0.02mol
D.该反应的化学方程式为3A(g)+B(g) 2C(g)
2C(g)
查看答案和解析>>
科目: 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:实验题
用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
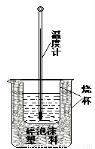
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和。泡沫塑料的作用是。
(2)若NaOH溶液用相同浓度和体积的下列溶液代替,则对中和热数值测定结果将如何影响(填“偏大”、“偏小”、“无影响”):KOH溶液;氨水(NH3·H2O)。
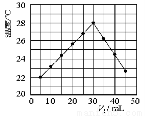
(3)某研究小组将V1mL1.0mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。由题干及图形可知,V1∶V2=时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为mol/L。
查看答案和解析>>
科目: 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:填空题
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
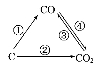
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为;
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)===CO2(g)ΔH1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)===CO(g)+H2(g)ΔH2>0;②
再燃烧水煤气:2CO(g)+O2(g)===2CO2(g)ΔH3<0,③
2H2(g)+O2(g)===2H2O(g)ΔH4<0。④
则途径Ⅰ放出的热量________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v正____v逆(填“>”“<”或“=”)。
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/kJ·mol-1 | 941.7 | 154.8 | 283.0 |
则反应N2(g)+3F2(g)═2NF3(g)的ΔH=
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2D.△H3=△H1﹣△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ·m ol-1,
ol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ·mol-1,
则O3转化为O2的热化学方程式为。
查看答案和解析>>
科目: 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行如下化学反应 :CO(g)+H2O
:CO(g)+H2O (g)
(g) CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________,该反应为______反应(填吸热或放热)。[
若改变条件使平衡向正反应方向移动,则平衡常数_________(填序号)
①一定不变②一定减小③可能增大④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是___________。
(a)容器中压强不变(b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O)(d)c(CO)=c(CO2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃[ |
| 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 1000 | 1 | 2 | c | d | t |
①实验B中平衡时H2O(g)的物质的量是。
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”)。
③若实验C中达到平衡所需时间t3(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目: 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:填空题
在100℃时,将0.200mol的四氧化二氮气体充入 2L真空的密闭容器中,每隔一定的时间对该
2L真空的密闭容器中,每隔一定的时间对该 容器内的物质进行分析,得到如下表格:?
容器内的物质进行分析,得到如下表格:?
时间min 浓度mol/L | 0 | 2 | 4 | 6 | 8 | 10 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:?
(1)该反应达到平衡时,四氧化二氮的转化率为 %,表中c2 c3、a b(填“>”、“<”或“=”)。
(2)2min时四氧化二氮的浓度c1=mol/L,在0~2min时间段内,四氧化二氮的平均反应速率为 mol/(L·min)。
(3)100℃时,该反应的平衡常数K=
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com