
科目: 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:填空题
氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点-54.1 ℃,沸点69.1 ℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3 kJ/mol
SO2Cl2(l) ΔH=-97.3 kJ/mol
(1)试写出常温常压下化学平衡常数K的表达式:K=_____________;
若在此条件下,将化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是________(选填编号)。
a.降低温度 b.移走SO2Cl2
c.增加反应物浓度 d.以上都不对
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是________(选填编号)。
a.缩小容器体积 b.使用催化剂
c.增加SO2浓度 d.升高温度
(3)在100 ℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有________(选填编号)。
a.只有37Cl2 b.只有SO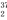 Cl2 c.37Cl2和SO
Cl2 c.37Cl2和SO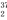 Cl2 d.无法判断
Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡的是________(选填编号)。
a.v(Cl2)=v(SO2)
b.容器中气体压强不随时间而变化
c.c(Cl2)∶c(SO2)=1∶1
d.容器中气体颜色不随时间而变化
查看答案和解析>>
科目: 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:实验题
用中和滴定法测定某盐酸的物质的量浓度。
(1)标准溶液应盛于________(填“A”或“B”)滴定管中。
(2)若选用酚酞作指示剂,以0.125 0 mol·L-1的标准氢氧化钠溶液滴定,如何判断滴定终点________________________。
(3)实验数据记录如下表,请分析数据并计算,盐酸的物质的量浓度=__________mol·L-1。
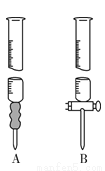
滴定次数 | 待测溶液体积/mL | ||
标准碱液 | |||
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.00 | 16.02 |
2 | 20.00 | 0.00 | 15.98 |
3 | 20.00 | 0.00 | 16.00 |
查看答案和解析>>
科目: 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:填空题
(1)某温度(t ℃)时,水的KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)__ __________25 ℃,其理由是____________。将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合,若所得混合液为中性,则a∶b=____________。
(2)已知25 ℃时0.1 mol/L醋酸溶液达到平衡(HAc H++Ac-)时的pH约为3,如果在此溶液中加入等体积的pH为5的盐酸,则电离平衡____________移动(填“向左”、“向右”或“不”);若向原醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后溶液的pH值____________(填“增大”、“减小”或“不变”)。
H++Ac-)时的pH约为3,如果在此溶液中加入等体积的pH为5的盐酸,则电离平衡____________移动(填“向左”、“向右”或“不”);若向原醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后溶液的pH值____________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:选择题
已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为 Y kJ/mol,则1 mol C与O2反应生成CO的反应热ΔH为____________
Y kJ/mol,则1 mol C与O2反应生成CO的反应热ΔH为____________
A.-Y kJ/mol B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol
查看答案和解析>>
科目: 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:选择题
一份NaOH溶液分成两等份后,分别用pH=2和pH=3的醋酸溶液完全中和,设消耗醋酸溶液的体积依次是Va L和Vb L,则Va和Vb之间的关系是
A.Va>10Vb B.Vb=10Va
C.Vb<10Va D.Vb>1 0Va
0Va
查看答案和解析>>
科目: 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:选择题
已知反应FeCl3+3KSCN Fe(SCN)3+3KCl,下列条件改变能导致平衡逆向移动的是
Fe(SCN)3+3KCl,下列条件改变能导致平衡逆向移动的是
①加入KCl固体 ②加入KCl溶液 ③加入FeCl3固体 ④加入KI固体 ⑤加压
A.①④ B.①② C.③⑤ D.②④
查看答案和解析>>
科目: 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:选择题
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示。
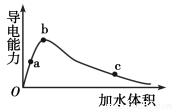
则下列说法错误的是
A.醋酸的电离程度:a<b<c
B.溶液的pH值:b<a<c
C.蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大
D.若分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c
查看答案和解析>>
科目: 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:选择题
已知2SO2(g)+O2(g) 2
2 SO3(g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
SO3(g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙>2P乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目: 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:选择题
常温常压下,下列各组离子在指定溶液中能大量共存的是
A.c(Fe3+)=0.1 mol/L溶液中:Na+、NH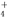 、SCN-、SO
、SCN-、SO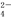
B.能溶解CaCO3的溶液中:Fe3+、Ca2+、Cl-、NO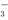
C.由水电离出的c(H+)=1×10-2mol/L的溶液中:Na+、Ba2+、HCO 、Cl-
、Cl-
D.强碱性溶液中:K+、Na+、ClO-、I-
查看答案和解析>>
科目: 来源:2016-2017学年湖南师大附中高二上期中理化学试卷(解析版) 题型:填空题
二氧化锰是化学工 业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+O2
业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+O2 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3 MnO+CO2 ②2MnO+O2
MnO+CO2 ②2MnO+O2 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,碳酸锰热分解反应的平衡常数K=____________(分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2的关系为______________。
(2)反应②在低温下能自发进行,则其ΔH______________0(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com