
科目: 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
现有常温时PH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是
A.加入10mL0.01mol·L-1的NaOH溶液
B.加入10mL的水进行稀释
C.加水稀释成100mL
D.加入10mL 0.01mol·L-1的HCl溶液
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
已知100℃时,水的离子常数积为1×10-12。100℃时0.1mol·L-1的HX溶液中,c (OH-)/c (H+) =1×10-6,在该条件下对0.1mol·L-1的HX溶液,下列说法中正确的是
A.HX的电离方程式为:HX=H+ + X-
B.此溶液的pH=1
C.该溶液中c(HX)> c (H+)> c (X-)>c (OH-)
D.NaX与HX的混合溶液一定显酸性
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
25℃,水的电离平衡:H2O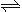 H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,c(H+)不变,pH不变
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)达到平衡时,C(H2)=0.5mol•L-1,c(HI)=3mol•L-1,则此温度下反应①的平衡常数为
H2(g)+I2(g)达到平衡时,C(H2)=0.5mol•L-1,c(HI)=3mol•L-1,则此温度下反应①的平衡常数为
A.12 B.16 C.20 D.25
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.NH4NO3溶于水虽然吸热,但其溶于水是自发过程
B.过热液体(温度高于沸点)会自发转变成气体,可用焓变解释
C.对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最大
D.有序火柴散落的自发过程可用能量判据解释
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.Na2S溶液的水解:S2-+2H2O H2S+2OH-
H2S+2OH-
B.NaHCO3溶液的电离:HCO3-+H2O H2CO3+OH-
H2CO3+OH-
C.NH4Cl溶液的水解:NH4++H2O NH3•H2O+H+
NH3•H2O+H+
D.把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
A. 中和滴定实验中指示剂不宜加入过多,通常量控制在1至2mLB用50mL酸式滴定管可准确量取25.00mLKMnO4溶液 B. 用量筒量取5.00mL1.00mol·L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol·L-1盐酸
C. 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:选择题
在相同温度时,100mL0.01mol·L-1的醋酸溶液和与10mL 0.1mol•L-1的醋酸溶液相比较,下列数据中,前者大于后者的是
A.H+的物质的量 B.醋酸电离常数
C.中和时所需氢氧化钠溶液的量 D.醋酸的物质的量
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:填空题
“嫦娥一号”探月成功,实现了中国人奔月的梦想
(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点除产生的热量大之外,还具有的优点是_______________________。
(2)下列是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式:
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
C(g)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) ΔH=-5518 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是________________。
(3)已知:H2(g)=H2(l) ΔH=-0.92 kJ/mol
O2(g)=O2(l) ΔH=-6.84 kJ/mol
H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
请写出液氢和液氧生成气态水的热化学方程式_______________。如果此次“嫦娥一号”所携带的燃料为1.08吨,液氢、液氧恰好完全反应生成气态水,总共释放能量___________kJ(保留3位有效数字)。
(4)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应为:负极放电的物质为__________________,正极:__________________,总反应式:__________________。
查看答案和解析>>
科目: 来源:2016-2017学年山西省高二上期中化学试卷(解析版) 题型:实验题
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:(1)以上步骤有错误的是(填编号)___________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_________;
(2)判断滴定终点的现象是:锥形瓶中溶液从__________色变为__________色,且半分钟不变色;
(3)下图是某次滴定时的滴定管中的液面,其读数为__________mL;
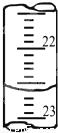
(4)根据下列数据:请计算待测盐酸溶液的浓度:__________mol/L.
滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com