
科目: 来源:2016-2017学年新疆生产建设兵团二中高二上期中化学卷(解析版) 题型:选择题
某同学将pH=1的盐酸平均分成2份,1份加入适量水,另一份加入与 该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
A. 12:l B.1l:1 C.10:1 D.9:1
查看答案和解析>>
科目: 来源:2016-2017学年新疆生产建设兵团二中高二上期中化学卷(解析版) 题型:选择题
常温下,向20mL某盐酸溶液中逐滴加入0.1mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是
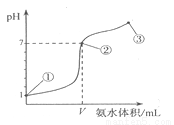
A.盐酸的物质的量浓度为1mol/L
B.在①、②之间的任意一点:c(Cl﹣)>c(NH4+),c(H+)>c(OH﹣)
C.在点③所示溶液中:由水电离出的c(O H﹣)>10﹣7mol/L
H﹣)>10﹣7mol/L
D.在点②所示溶液中:c(NH4+)=c(Cl﹣)>c(OH﹣)=c(H+),且V <20
查看答案和解析>>
科目: 来源:2016-2017学年新疆生产建设兵团二中高二上期中化学卷(解析版) 题型:选择题
用已知物质的量浓度的HCl溶液滴定未知浓度的NaOH溶液时,下列操作会导致测定结果偏高的是
①酸式滴定管用蒸馏水洗后未用待装液润洗;②碱式滴定管用蒸馏水洗后未用待装液润洗;③滴定前酸式滴定管尖嘴处未充满溶液,滴定终点充满溶液;④取碱液时滴定管尖嘴处未充满溶液,取完后,充满溶液;⑤锥形瓶用蒸馏水洗后再用待测液润洗;⑥滴定时摇动锥形瓶将液体溅出瓶外;⑦滴定过程中,滴定管漏出液体,溅至锥形瓶外;⑧读取标准溶液体积时,滴定前仰视,滴定后俯视。
A.②④ B.①③⑤⑦ C.④⑧ D.②④⑥⑧
查看答案和解析>>
科目: 来源:2016-2017学年新疆生产建设兵团二中高二上期中化学卷(解析版) 题型:选择题
常温下,下列有关离子浓度及pH大小的比较正确的是
A.NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为③>②>①
B.由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积和混合,其离子浓度不可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.pH=13的Ba(OH)2溶液与pH=1的盐酸等体积混合,混合溶液的 pH>7
D.pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13.7
查看答案和解析>>
科目: 来源:2016-2017学年新疆生产建设兵团二中高二上期中化学卷(解析版) 题型:选择题
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 m ol·L-1 NaOH溶液,pH变化曲线如图所示(忽略温度),以下叙述正确的是
ol·L-1 NaOH溶液,pH变化曲线如图所示(忽略温度),以下叙述正确的是
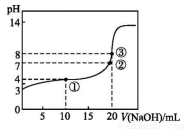
A.根据图中数据可计算出K值约为1×10-5
B.①②③点水的电离程度由大到小的顺序为:②>③>①
C.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D.点③时c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1
查看答案和解析>>
科目: 来源:2016-2017学年新疆生产建设兵团二中高二上期中化学卷(解析版) 题型:填空题
(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制 AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的 。
查看答案和解析>>
科目: 来源:2016-2017学年新疆生产建设兵团二中高二上期中化学卷(解析版) 题型:填空题
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
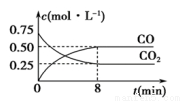
(1)该反应的平衡常数表达式K=____________。
(2)下列措施中能使平衡常数K增大的是__________(填序号)
A.升高温度 B .增大压强 C.充入一定量CO D.降低温度
.增大压强 C.充入一定量CO D.降低温度
(3)8 min内,CO的平均反应速率v(CO)=____________mol·L-1·min-1。
(4)1 100 ℃时,2 L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 3 mol Fe、2 mol CO2 | 4 mol FeO、3 mol CO |
CO的浓度(mol·L-1) | c1 | c2 |
CO2的体积分数 | φ1 | φ2 |
体系压强(Pa) | p1 | p2 |
气态反应物的转化率 | α1 | α2 |
①下列说法正确的是____________。
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=____________、φ1=____________、α2=____________。
查看答案和解析>>
科目: 来源:2016-2017学年新疆生产建设兵团二中高二上期中化学卷(解析版) 题型:填空题
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) yC(g) ΔH<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
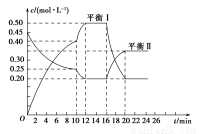
(1)根据图示可确定x∶y=________。
(2)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是____________;第16 min引起曲线变化的反应条件可能是____________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1____________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源:2016-2017学年新疆生产建设兵团二中高二上期中化学卷(解析版) 题型:填空题
(1)将等体积等物质的量浓度的醋酸和氢 氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” 下同)。
氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” 下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-) 。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
查看答案和解析>>
科目: 来源:2016-2017学年新疆生产建设兵团二中高二上期中化学卷(解析版) 题型:实验题
某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 |
| 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
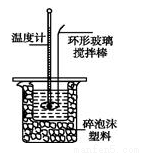

(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____________。大烧杯如不盖硬纸板,求得的中和热数值将 (填“偏大”、“偏小”或“无影响”)。结合日常生活实际该实验在 中(家用产品)效果更好。
(3)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(4)取50 mLNa OH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
OH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 2 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
表中的温度差平均值为 ℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55 mol·L-1氢氧化钠进行反应,与上述实验相比,所放出的热量 (填相等或不相等,下同) ,所求的中和热 简述理由 。
,所求的中和热 简述理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com