
科目: 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列固体,能减慢反应速率但又不影响氢气生成量的是( )
A.K2SO4 B.CH3COONa C.CuSO4 D.Na2CO3
查看答案和解析>>
科目: 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少4 mol A,乙容器内每分钟减少2 mol A,则甲容器内的反应速率比乙容器内的反应速率( )
A.快 B.慢 C.相等 D.无法判断
查看答案和解析>>
科目: 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
对于反应N2(g)+3H2(g)  2NH3(g) ΔH<0,达到平衡后,以下分析正确的是( )
2NH3(g) ΔH<0,达到平衡后,以下分析正确的是( )
A.增大压强,对正反应的反应速率影响更大
B.升高温度,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,对逆反应的反应速率影响更大
查看答案和解析>>
科目: 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
下列有关热化学方程式的表示及说法正确的是 ( )
A.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中
和热的热化学方程 式为:NaOH(aq)+1/2H2SO4 (aq)=1/2Na2SO4 (aq)+H2O(l) △H=-57.4kJ/mol
式为:NaOH(aq)+1/2H2SO4 (aq)=1/2Na2SO4 (aq)+H2O(l) △H=-57.4kJ/mol
C.已知C(石墨,s)=C(金刚石, s) △H>0,则金刚石比石墨稳定
s) △H>0,则金刚石比石墨稳定
D.已知I2(g)+ H2(g)=2HI(g) △H1<0, I2(s)+ H2(g)=2HI(g ) △H2<0,则△H1>△H2
查看答案和解析>>
科目: 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
把0.05 mol NaOH固体分别加入到下列100 mL溶液中,导电能力变化较大的是 ( )
A.0.5 mol·L-1 MgSO4溶液
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1的CH3COOH溶液
D.0.5 mol·L-1 NH4Cl溶液
查看答案和解析>>
科目: 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.水的电离方程式:H2O===H++OH-
B.pH=7的溶液一定是中性溶液
C.升高温度,水的电离程度增大
D.将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
查看答案和解析>>
科目: 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是 ( )
A.c(H+) B.Ka(HF) C.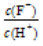 D.
D.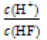
查看答案和解析>>
科目: 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1 )的措施是 ( )
)的措施是 ( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 mol·L-1盐酸
D.提高溶液的温度
查看答案和解析>>
科目: 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
PH=3的盐酸和醋酸各100mL,分别和锌反应,反应完后,放出的气体一样多.若最后有一溶液中锌剩余,则下列判断正确的是( )
A.反应开始时速 率v(HCl)>v(CH3COOH)
率v(HCl)>v(CH3COOH)
B.加入的锌质量相等
C.盐酸中锌有剩余
D.反应开始后不久,醋酸反应的速率小于盐酸
查看答案和解析>>
科目: 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
已知25℃时,有关弱酸的电离平衡常数如下表:
化学式 | CH3COOH | HCN |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 |
下列有关说法正确的是( )
A.体积和pH相同的CH3COOH溶液与HCN溶液,分别与足量的Fe反应,HCN溶液产生的H2更多
B.体积和pH相同的CH3COOH溶液与HCN溶液,中和NaOH溶液所消耗NaOH的物质的量相同
C.amol·L-1HCN溶液加水稀释后,电离平衡常数减小,加入KCN晶体后,电离平衡常数增大
D.25℃时,在等浓度的CH3COOH溶液与HCN溶液中,水的电离程度前者大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com