
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2 2SO3),反应过程中的能量关系可用右图简单表示(图中的ΔH 表示生成1 mol产物的数据)。 下列说法正确的是( )
2SO3),反应过程中的能量关系可用右图简单表示(图中的ΔH 表示生成1 mol产物的数据)。 下列说法正确的是( )

A.S8的燃烧热 ΔH=-a kJ·mol-1
B.1 mol SO2和过量 O2反应可释放出 b kJ 的热量
C.已知1个S8分子中有8个S-S,S=O的键能为d kJ·mol-1,O=O的键能为e kJ·mol-1,则S8分子中S-S的键能为(2d-a-e) kJ·mol-1
D.若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
苯甲酸钠(NaA)可作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2。已知25 ℃时,HA、H2CO3的电离平衡常数分别为 K=6.25×10-5、 K1=4.3×10-7,则下列说法正确的是(不考虑饮料中其他成分) ( )
A.提高CO2充气压力,饮料中c(A-)不变
B.当pH为5.0时,饮料中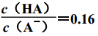
C.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D.结合H+的能力:A-> HCO3-
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
在不同温度下,将2mol X、2mol Y分别充入到不同体积的容器中,发生反应:X(g)+Y (g) mZ(g) ΔH,所得Z的平衡浓度如表所示,下列说法正确的是( )
mZ(g) ΔH,所得Z的平衡浓度如表所示,下列说法正确的是( )
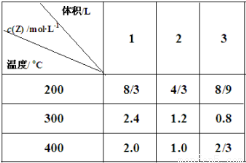
A.m=2 ,ΔH>0
B.300℃时,该反应平衡常数 K=9
C.在3L容器中进行反应,达到平衡的时间:400℃>200℃
D.200℃,2L容器中反应达平衡后,再充入2 mol Z,平衡时 Z 的体积分数增大
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
将一定量纯净的 X 置于某 10 L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s) 2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10-8 mol3·L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.若Z的体积分数不再随时间变化时表示反应达平衡状态
B.35 oC时,达平衡时,X分解了 0.03 mol
C.该反应在高温下可能自发
D.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
磷在氧气中燃烧,可能生成P2O3和P2O5,已知单质磷(P)的燃烧热为X kJ/mol,0.1molP在2.24 LO2(标准状况下)燃烧至反应物耗尽时,放出Y kJ 的热量,则下列说法错误的是( )
A.生成0.025 mol P2O5
B.生成 P2O3所释放的热量为(Y-0.05X) kJ
C.2P(s)+3/2O2(g)= P2O3(s) ΔH =-(40Y-2X)kJ·mol-1
D.生成的 P2O3与 P2O5的质量之比为 1:1
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、 NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
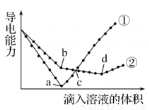
A.①代表滴加H2SO4溶液的变化曲线
B.b点,水电离产生的c(H+)< 10-7 mol/L
C.c点,两溶液中含有相同量的 OH-
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
如图,隔板K可左右移动,甲中充入2 mol A和1 mol B,乙中充入2mol C和1mol He,此时K 停在0处,发生反应2A(g)+B(g) 2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是( )
2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是( )
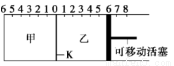
A.达平衡后,K最终停留在左侧刻度0~2之间
B.若平衡时K在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:实验题
某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如下:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1 KMnO4 酸性溶液 |
② | 20 mL 0.2 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1 KMnO4 酸性溶液 |

(1)检验上图装置气密性的最简便方法为:____________。
(2)H2C2O4溶液与酸性 KMnO4溶液反应的化学方程式为____________。
(3)该实验探究的是___________因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是___________(填实验序号)。
(4)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________(若忽略溶液混合前后体积的变化)。
(5)小组同学发现反应速率总是如上右图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①__________、②_________、③K+对该反应有催化作用。
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+ 550 kJ/mol,它由两步反应组成:
i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ/molii.SO3(g)分解。
(1)SO3(g)分解的热化学方程式为________________。
(2)工业上常用SO2制备Na2S2O3,向0.1 mol/L的Na2S2O3溶液中滴加稀硫酸的离子方程式为_________。
(3)反应ii的△S_______________0(填 “>”、 “<”、 “=”)。
(4)对反应ii,可用V2O5 作催化剂。已知:SO2+V2O5 SO3+V2O4 K1、1/2O2+V2O4
SO3+V2O4 K1、1/2O2+V2O4 V2O5 K2, 则在相同温度下,2SO3(g)
V2O5 K2, 则在相同温度下,2SO3(g) 2SO2(g)+O2(g)的平衡常数 K=______________(用K1、K2表示)。
2SO2(g)+O2(g)的平衡常数 K=______________(用K1、K2表示)。
(5) L(L1、L2),X可分别代表压强或温度,右图表示L一定时,反应ii中SO3(g)的平衡转化率随X的变化关系。
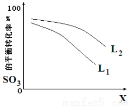
①X代表的物理量是_________________;
②比较L1、L2的大小_________________。
(6)维持体系总压p恒定,在T oC时,物质的量为9 mol、体积为2L的SO3(g)发生反应:2SO3(g) 2SO2(g)+O2(g), 已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=_____________(用最简分数表示)。
2SO2(g)+O2(g), 已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=_____________(用最简分数表示)。
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
雾霾严重影响人们的生活, 雾霾的形成与汽车排放的 NOx等有毒气体有关。
(1)可以通过活性炭处理汽车尾气,原理为:C(s)+2NO(g) N2(g)+CO2 (g) ∆H<0。
N2(g)+CO2 (g) ∆H<0。
①下列情况能说明该反应达到平衡状态的是( )
A.2ν正(NO) =ν逆(CO2)
B.在恒温、恒容的容器中,混合气体的压强保持不变
C.在绝热、恒容的容器中,反应的平衡常数不再变化
D.在恒温、恒压的容器中, 混合气体的密度保持不变
②在恒温、恒容条件下, 加入2 mol C(s)和2 mol NO(g)达平衡后,再在绝热、恒容条件下,加入1 mol NO重新达平衡后, N2的百分含量将____________(填“增大”、“减小”、“不变”)。
(2)臭氧是理想的烟气脱硝试剂,原理为:2NO2(g)+O3(g) N2O5(g)+O2(g)。若在容积为10L的密闭容器中进行该反应,起始时充入0.4 molNO2、0.2 molO3,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
N2O5(g)+O2(g)。若在容积为10L的密闭容器中进行该反应,起始时充入0.4 molNO2、0.2 molO3,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
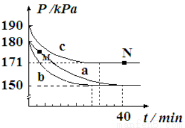
①实验a从开始至平衡时的反应速率v(O3)=_________;实验c中NO2的平衡转化率为___________。
②与实验a相比,其他两组改变的实验条件分别是:b_________,c__________。
③M点的逆反应速率 v(逆)____________N点的正反应速率v(正)(填“>”、“<”或“=”)。
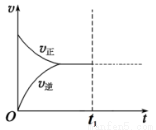
④若在N点时,维持温度和压强不变,t1时再加入0.4 molNO2、0.2 mol O3,请在图中画出逆反应速率在t1后随时间t的变化曲线图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com