
科目: 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是 ( )
操作 | 现象 | 结论 | |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO |
B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显橙红色 | 原溶液中有Br- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
D | 加入AgNO3溶液,生成白色沉淀,加稀盐酸 | 沉淀不溶解 | 原溶液中有Cl-存在 |
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示。下列分析正确的是 ( )
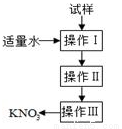
A.操作Ⅰ是过滤,将固体分离除去
B.操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠
C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来
D.操作Ⅰ~Ⅲ总共只需一次过滤操作
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
如下图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是
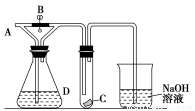
A.浓H2SO4 B.浓盐酸 C.NaOH溶液 D.饱和NaCl溶液
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的气体摩尔体积比乙的气体摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况) B.转移电子的物质的量为1.25 mol
C.有0.250 mol KNO3被氧化 D.被氧化的N原子的物质的量为3.75 mol
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:填空题
每空分共(1)现有①硫酸②酒精③液氨④纯碱⑤熔融的氢氧化钠⑥水银⑦三氧化硫⑧澄清石灰水等物质中,属于盐的是(填序号,下同) ,属于酸性氧化物的是 ,能导电的是 ,属于电解质的是 。
(2)有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
①写出丙元素的元素符号 。
②写出甲、乙、丙三种元素组成的化合物在水中的电离方程式 。
③画出甲元素的原子结构示意图 。
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:填空题
氯气是一种重要的化工原料,是氯碱工业的主要产品之一,它是一种常用的消毒剂。
①实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是______________________
②氯碱工业生产氯气的化学方程式为______________________
③由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是______________________,在空气中漂白粉长期存放会变质而失效的原理是(用化学方程式说明) _____________。
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:填空题
(1)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为 ,其相对式量为 ,X的相对原子质量为 ,该物质的化学式为 。
(2)在新制氯水中存在的各种粒子中:(用化学式或离子符号填写,下同)
①使氯水呈黄绿色的是 ;②能使硝酸银溶液产生白色沉淀的是 ;
③能使紫色石蕊试液显红色的是 ;④能使湿润的红纸褪色的是 ;
⑤能使无水硫酸铜变蓝的是 ;⑥能与碳酸氢钠溶液反应放出气体的是 。
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:实验题
碘化钠是实验室中常用的分析试剂,工业上用铁屑还原法制备NaI的流程如图所示。

请回答下列问题:
(1)判断反应①中碘是否反应完全的方法是 。
(2)操作Ⅰ的名称是 。
(3)反应①的化学方程式为 。
(4)反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,写出该反应的化学方程式并用双线桥法表示此反应的电子转移的方向及数目
(5)在反应②中若有99 g NaIO3被还原,则转移电子的物质的量为 mol。
查看答案和解析>>
科目: 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:实验题
分,共实验室用密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸配制240 mL 0.1 mol·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为 。
(2)配制240 mL 0.1 mol·L-1的盐酸应量取浓盐酸体积 mL,应选用容量瓶的规格______mL。
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯内壁和玻璃棒2~3次,洗涤液均注入容量瓶,振荡 |
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀 |
C.将已冷却的盐酸沿玻璃棒注入容量瓶中 |
D.将容量瓶盖紧,振荡,摇匀 |
E.改用 加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线 处
(4)操作A中,将洗涤液都移入容量瓶,其目的是
(5)若实验过程中出现如下情况如何处理?
①加蒸馏水时不慎超过了刻度线
②向容量瓶中转移溶液时不慎有溶液溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com