
科目: 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:选择题
在体积均为1.0 L的恒容两个密闭容器中分别 加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
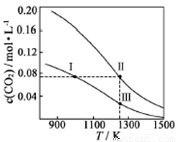
A.化学平衡常数K:K(状态I) < K(状态II) <K(状态III)
B.CO2的平衡转化率α:α(状态I) <α(状态Ⅱ)=α(状态III)
C.体系中c(CO):c (CO,状态Ⅱ) < 2c (CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)> v逆(状态Ⅲ)
查看答案和解析>>
科目: 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:实验题
用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4·H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品 纯度。
纯度。
(1)步骤Ⅰ中,滤渣的主要成分是 。
(2)将MnO2氧化Fe2+的离子方程式补充完整:
MnO2 +  Fe2+ +
Fe2+ + =
= Mn2+ +
Mn2+ +  Fe3+ +
Fe3+ +
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 。
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 。
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度。
已知一定条件下,MnO4-与Mn2+反应生成MnO2 。取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y m L,产品中锰元素的质量分数为 (用含x、y表示)
L,产品中锰元素的质量分数为 (用含x、y表示)
查看答案和解析>>
科目: 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:简答题
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:
C(s)+H2O(g) CO(g)+H2(g)ΔH=+131.4kJ/mol
CO(g)+H2(g)ΔH=+131.4kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密 度增
度增 大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为______________________。
大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为______________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:

①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
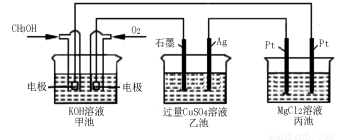
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当 甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
查看答案和解析>>
科目: 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:实验题
硫代硫酸钠(Na2S2O3)又名大苏打、海波,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室常以硫化钠(Na2S)为原料制取Na2S2O3。
实验项目I:工业级硫化钠的纯化。
本实验对Na2S的纯度要求较高,利用图1所示的装置将工业级 的Na2S提纯。
的Na2S提纯。


图1 图2
已知:Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。
提纯步骤依次为:
① 将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
② 按图1所示连接仪器,水浴加热;
冷凝管的作用是 。
向冷凝管中通入冷却水的方向是从 口进水(填“a”或“b”)。
③ 待烧瓶中固体不再减少时,停止加热,将烧瓶取下,趁热过滤,除去不溶物;
 ④ 将滤液转移至烧杯中,冷却结晶,过滤;
④ 将滤液转移至烧杯中,冷却结晶,过滤;
⑤ 将所得固体用少量 (填试剂名称)洗涤,干燥后得到Na2S·9H2O晶体。
实验项目II:硫代硫酸钠的制备。
制备步骤依次为:
① 称取一定质量的硫化钠晶体和碳酸钠固体,溶于水,转移至三颈瓶中;
② 按图2所示连接仪器,并在各仪器中加入相应的试剂,打开分液漏斗的活塞,使反应生成的气体较均匀地通入三颈瓶中,并用电磁搅拌器不断搅拌;
仪器A的名称为 。
写出三颈瓶中发生的反应的化学方程式: 。
③ 随着气体的通入,逐渐有浅黄色的硫析出,继续通入气体至溶液pH接近7,停止通入气体,取下三颈烧瓶,过滤;
实验过程中若未及时停止通入气体可能产生的后果为 。
④ 将滤液置于蒸发皿中加热,待 时,停止加热,冷却,过滤,即得Na2S2O3·5H2O晶体。
查看答案和解析>>
科目: 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:简答题
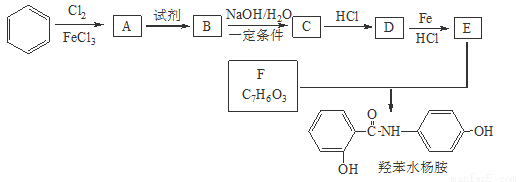
常用药——羟苯水杨胺,其合成路线如下。回答下列问题:
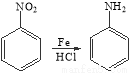
已知:
(1)羟苯水杨胺的化学式为 。
对于羟苯水杨胺,下列说法正确的是___________。
A.1 mol羟苯水杨胺最多可以和2 mol NaOH反应
B.不能发生硝化反应
C.可发生水解反应
D.可与溴发生取代反应
(2)D的名称为 。
(3)A→B所需试剂为 ;D→E反应的有机反应类型是 。
(4)B→ C反应的化学方程式为 。
(5)F存在多种同分异构体。
①F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是 。
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
②F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的物质共有 种;写出其中核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的结构简式 。
查看答案和解析>>
科目: 来源:2017届辽宁省铁岭市协作体高三第三次联考化学试卷(解析版) 题型:选择题
设 NA为阿伏伽德罗常数的数值,下列说法正确的是( )
NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.标准状况下,11.2L SO3中含有的分子数为0.5NA
B.常温下,46gNO2和N2O4的混合气体中含有原子总数为3NA
C.1mol C10H22含共价键数目32NA
D.1L 2mol/L的MgCl2溶液中含Mg2+ 数为2NA
查看答案和解析>>
科目: 来源:2017届辽宁省铁岭市协作体高三第三次联考化学试卷(解析版) 题型:选择题
下列离子方程式与所述事实相符且正确的是( )
A.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O
B.Ca(HCO3)2溶液中加入少量NaOH溶液: Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O
C.明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:
4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
查看答案和解析>>
科目: 来源:2017届辽宁省铁岭市协作体高三第三次联考化学试卷(解析版) 题型:选择题
标准状况下,m1g气体A与m2g气体B的分子数相等,下列说法中正确的是( )
A.1个A分子的质量是1个B分子的质量的 倍
倍
B.同温同体积的A与B的质量比为
C.同温同质量的A与B的分子数比为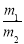
D.同温同压下A与B的密度比为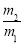
查看答案和解析>>
科目: 来源:2017届辽宁省铁岭市协作体高三第三次联考化学试卷(解析版) 题型:选择题
工业上用固体硫酸亚铁制取颜料铁红,反应原理是:2FeSO4  Fe2O3+SO2↑+SO3↑。某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、( II ) x 溶液、(III)NaOH 溶液的三个装置。则下列对该方案的评价中正确的是 ( )
Fe2O3+SO2↑+SO3↑。某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、( II ) x 溶液、(III)NaOH 溶液的三个装置。则下列对该方案的评价中正确的是 ( )
A.(I)中会生成 BaSO3、BaSO4两种沉淀
B.可将(I)中的 BaCl2溶液改为 Ba(NO3)2溶液
C.(II)所盛 x 应为品红溶液
D.(III)的作用是检验生成的SO2 气体
查看答案和解析>>
科目: 来源:2017届辽宁省铁岭市协作体高三第三次联考化学试卷(解析版) 题型:选择题
类推的思维方法在化学学习和研究中有时会产生错误的结论,因此类比推出的结论最终要经过实践的检验才能决定其正确与否。下列类推结论中正确的是( )
A.Cu与Cl2直接化合生成CuCl2;Cu与S直接化合也能得到CuS
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
C.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
D.工业上电解熔融MgCl2制取金属镁;也用电解熔融AlCl3的方法制取金属铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com