
科目: 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:选择题
Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述正确的是( )
A.电池放电时正极上有气泡产生 B.电池放电时Cl-由负极向正极迁移
C.正极反应式为Ag++e-=Ag D.负极副反应为Mg+H2O=Mg(OH)2+H2↑
查看答案和解析>>
科目: 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:选择题
某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+ LixC6=LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-=xLi++C6
C.充电时,若转移lmole-,石墨C6电极将增重7xg
D.充电时,阳极的电极反应式为LiCoO2-xe-= Li1-xCoO2+Li+
查看答案和解析>>
科目: 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:选择题
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两瑞隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )

A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2 H2O–4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目: 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:选择题
锌-空气燃料电池可用作电动车动力电源,电池的电解质溶滚为KOH溶液,反应为2Zn+O2+ 4OH-+2H2O=2Zn(OH)42-。下列说法正确的是( )
A.放电时,负极反应为:Zn+4OH--2e-=Zn(OH)42-
B.充电时,电解质溶液中K+向阳极移动
C. 充电时,电解质溶液中c(OH-)逐渐减小
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目: 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:选择题
金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )

A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属-空气电池,Al-空气电池理论比能量最高
C. M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
D.在M-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目: 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:选择题
煤炭燃烧中会产生大量烟气容易透成污染,用下图所示的电解池在较高温度下反应,可以净化烟气,则下列列断不正确的是( )
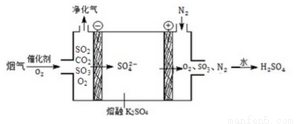
A.据图可知,阳极反应式为SO42--2e-=SO2↑+O2↑
B.SO2在阴极与O2反应生成硫酸根,则方程式为SO2+O2+2e-= SO42-
C.阳极失去2mol电子时,理论上可以得到标准状况下11.2L氧气
D.CO2不参与电极反应,净化器中CO2浓度升高
查看答案和解析>>
科目: 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:填空题
化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-=FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只有在强碱性条件下稳定,易被H2还原。
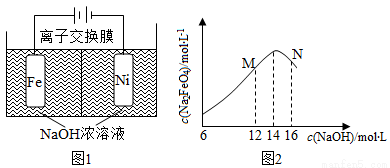
①电解一段时间后,c(OH-)降低的区域在__________(城 “阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目: 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:填空题
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe +2H2O=Fe(OH)2+Ni(OH)2
(1)金属镍在元素周期表中的位置是______________。
(2)此蓄电池放电时,该电池发生氧化反应的物质是________(城序号)。
A. NiO2 B.Fe C. Fe(OH)2 D.Ni(OH)2
(3)此蓄留电池充电时,阳极的电极反应式是____________。
(4)用该蓄电池电解含有0.2molNaCl的混合溶液100mL,假如电路中转移了0.1mo电子,且电解池的电极均为惰性电极。阳极产生的气体在标准状况下的体积是________;将电解后的溶液加水稀释至1L,此时溶液的pH=________________。
(5)该电池电极材料对环境有危害。在对电池进行回收处理过程中遇到以下问题:己知:常温下Ksp[Fe(OH)3]=1.0×10-34,Ksp[Ni(OH)2]=1.0×10-15。某溶液中含有0.1mol/L的Ni2+和0.1mol/LFe3+,当逐滴加入NaOH溶液(忽略溶液体积改变),
①先沉淀的离子是________。
②要想使Fe3+沉淀完全,Ni2+不沉淀,溶液的pH需控制的范围是__________。
查看答案和解析>>
科目: 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:填空题
(1)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。


①M区发生的电极反应式为___________。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为__________g(假设溶液电解前后体积不变)。
(2)①利用反应NO2+NH2―→N2+H2O(未配平)消除NO2的简易装置如图所示。电极b的电极反应式为______________;消耗标准状况下4.48 L NH3时,被消除的NO2的物质的量为________mol。
②合成氨的原料气需脱硫处理。一种脱硫方法是:先用Na2CO3溶液吸收H2S生成NaHS;NaHS再与NaVO3反应生成S、Na2V4O9和物质X。NaHS再与NaVO3反应的化学方程式为____________。
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上11月考试化学卷(解析版) 题型:选择题
已知: ①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为 283 kJ
B.反应①正反应活化能与逆反应活化能之差为+566 kJ/mol
C.反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com