
科目: 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
按下图所示装置进行实验,若x轴表示流入阴极的电子的物质的量,则y轴应表示( )
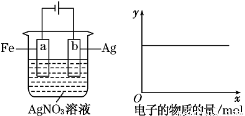
①c(Ag+) ②c(NO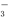 ) ③a棒的质量
) ③a棒的质量
④b棒的质量 ⑤c(H+)
A.①③ B.③④ C.①②④ D.①②⑤
查看答案和解析>>
科目: 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
实验发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
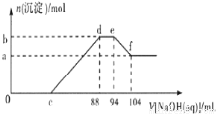
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应NaOH溶液的体积为48 mL
C.b点与a点的差值为0.05 mol
D.样品中铝粉和铁粉的物质的量之比为5:3
查看答案和解析>>
科目: 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )。
A.Ba2+(aq)+SO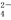 (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO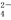 (aq)===BaSO4(s) ΔH=-18 kJ·mol-1
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1
C.Ba2+(aq)+SO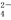 (aq)===BaSO4(s) ΔH=-73 kJ·mol-1[来源
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1[来源
D.Ba2+(aq)+SO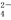 (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
查看答案和解析>>
科目: 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:填空题
已知115号元素原子有七个电子层,且最外层有5个电子, 115号元素在元素周期表中的位置是________________。
查看答案和解析>>
科目: 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:填空题
在熔融碳酸盐燃料电池中的应用以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如右:
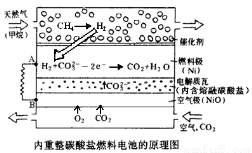
(1)外电路电子流动方向:由 流向 (填字母A 或B)。
(2)空气极发生反应的离子方程式是 。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e‑ 转移,有 g 精铜析出。
查看答案和解析>>
科目: 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:填空题
(1)由金红石?TiO2?制取单质Ti,涉及到的步骤为:
TiO2 TiCl4
TiCl4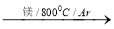 Ti
Ti
已知:① C?s?+O2?g?=CO2?g?; ?H=?393?5 kJ·mol?1
② 2CO?g?+O2?g?=2CO2?g?; ?H=?566 kJ·mol?1
③ TiO2?s?+2Cl2?g?=TiCl4?s?+O2?g?; ?H=+141 kJ·mol?1
则TiO2?s?+2Cl2?g?+2C?s?=TiCl4?s?+2CO?g?的?H= 。
(2)已知:①Zn(s)+1/2 O2(g)=ZnO(s);ΔH=-348.3 kJ/mol
②Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s);ΔH=-317.3 kJ/mol
则1 mol Ag(s)和足量O2(g)完全反应生成Ag2O(s)时,放出的热量为 kJ。
查看答案和解析>>
科目: 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:填空题
盐酸、硫酸和硝酸是常见的“三大酸”。现就三大酸与金属铜反应的情况,回答问题:
(1)稀盐酸不与Cu 反应,若在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为:____________________________。
(2)在一定体积的10mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积__________(填“大于”、“ 等于”或“小于”)180mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为_____________________。
(3)镁铁混合物4.8g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2 .24LNO气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是_________克。
查看答案和解析>>
科目: 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:填空题
A、B、C、D、E都是短周期的主族元素,原子序数依次增大,A、B处于同周期,C、D、E同处另一周期,C、A可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙,D是地壳中含量最高的金属元素,E的最高价氧化物对应的水化物是酸性最强的含氧酸。回答下列问题:
(1)B和E分别对应的氢化物的化学式为HB、HE,氢化物的沸点HB HE(填“>”、“<”、“=”,下同) ,氢化物的稳定性HB HE。
(2)物质乙的电子式为 ;物质乙可用于呼吸面具作供氧剂,写出乙与CO2反应的化学方程式:____________________________ 。
(3)元素C的最高价氧化物对应水化物和D的简单阳离子按照物质的量之比为7︰2在水溶液中反应的离子方程式:______________________________。
(4)1 mol 单质B的气体与1 mol C的氢氧化物在一定条件下恰好完全反应,生成一种盐、水及另一种气体,则所得气体的化学式为:___________。
查看答案和解析>>
科目: 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:推断题
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+ 、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。有一种气体是红棕色。请回答下列问题:
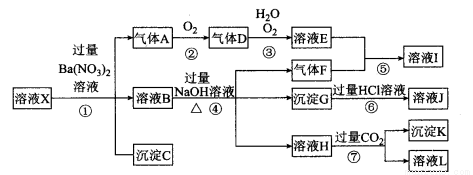
(1)溶液X中除了H+一定存在的离子有________________ 。溶液X中一定不存在的离子有____________ 。
(2)产生气体A的离子方程式为________________________________。
(3)转化⑥发生反应的现象为__________________________________。
(4)转化⑦中的离子方程式为___________________________________。
(5)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中O2与D的物质的量之比为________。
查看答案和解析>>
科目: 来源:2017届云南省高三上第四次月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.泡沫灭火器的灭火原理是硫酸铝与苏打溶液发生反应
B.食用油反复加热会产生稠环芳烃等有害物质
C.用FeCl3腐蚀印刷电路板是因为铁的金属性强于铜
D.工业酒精浓度高于医用酒精,所以其消毒能力更强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com