
科目: 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:填空题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视,所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
______ C+______ KMnO4+______H2SO4→______CO2↑+______MnSO4+______K2SO4+______H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=_________(取小数二位,下同)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则 的值_________(填具体值或取值范围)。
的值_________(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正________V逆 (填“<”,“>”,“=”)
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
③H2O(g)=H2O(l) △H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______________。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_______________。
查看答案和解析>>
科目: 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:实验题
过硫酸钾(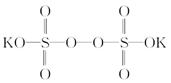 )具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
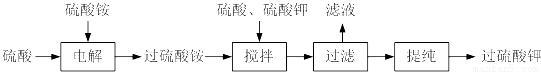
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式___________________。
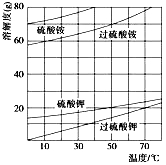
(2)已知相关物质的溶解度曲线如下图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,___________,干燥。
(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.3000g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.000g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能__________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是__________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为__________。
③为确保实验结果的准确性,你认为还需要____________________。
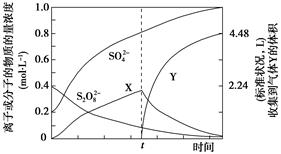
(4)将0.40mol过硫酸钾与0.20mol硫酸配制成1 L溶液,在80℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为
__________。
查看答案和解析>>
科目: 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:推断题
有机物G是合成某种耐热聚合物的单体,其合成方法如下:

已知:R1COOR2+R3OH RCOOR3+R2OH
RCOOR3+R2OH
(1)根据系统命名法,A的名称为____________。
(2)上述流程中的取代反应除②、③外还有__________________(填序号)
(3)化合物E的核磁共振氢谱图中共有多个吸收峰,各峰的锋面积比为________。
(4)按下图合成路线可得到F的同分异构体H,则可鉴别H和F的试剂是_____________
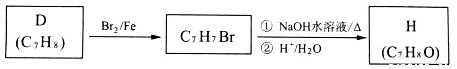
(5)C与足量NaOH溶液反应的化学方程式为______________ 。
(6)J与C互为同分异构体,其具有如下性质。符合要求的有机物有_______种(不考虑立体异构)
① 能与NaOH溶液反应,且1mol J完全反应消耗4molNaOH;
② 能发生银镜反应,且1mol J与足量的银氨溶液反应生成4molAg;
③ 分子中苯环上的一氯取代物只有一种。
查看答案和解析>>
科目: 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:实验题
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:
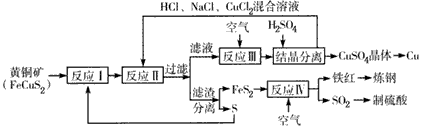
注:反应II的离子方程式为Cu2+ +CuS+4Cl- ═2[CuCl2]-+S↓
请回答下列问题;
(1)反应I的产物为 (填化学式)。
(2)反应Ⅲ的离子方程式为 。
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是 。
(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均成酸性,相同条件下,同浓度的两种水溶液c(SO32-)较小的是 。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3 溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00Ml。 已知:Cr2O72- +Fe2+ +H+→Cr3+ +Fe3+ +H2O(未配平)反应IV所得气体中SO2的体积分数为 。
查看答案和解析>>
科目: 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
下列变化属于化学变化的是
A.汽油挥发 B.燃放烟花 C.活性炭吸附冰箱内异味 D.分离液态空气制氧气
查看答案和解析>>
科目: 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
下列关于蒸馏操作的有关叙述不正确的是( )
A. 冷凝管进出水的方向是下进上出
B. 在蒸馏烧瓶内放入少量碎瓷片,目的是防止暴沸
C. 蒸馏操作使用的温度计的水银球应插入到液体内
D. 蒸馏操作主要仪器是:蒸馏烧瓶、酒精灯、铁架台、冷凝管、锥形瓶、温度计等
查看答案和解析>>
科目: 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
生物学家借助新的显微技术,成功观察到小于200纳米的粒子。下列分散系中,分散质粒子半径最小的是( )
A.雾 B.蛋白质溶液 C.石灰乳 D.KNO3溶液
查看答案和解析>>
科目: 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
图中三位同学正在讨论某一物质,他们所描述的物质是( )

A.HCl B.SO2 C.CO2 D.Cl2
查看答案和解析>>
科目: 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
下列有关阿伏加德罗常数为(NA)的说法错误的是( )
A.0.5NA个氯气分子的物质的量是0.5 mol
B.1 mol H2O含有的H2O分子数目为NA
C. 0.5 mol H 2O含有的原子数目
2O含有的原子数目 为NA
为NA
D. 32 g O2所含的氧原子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com