
科目: 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
将16.8 g铁和0.3 mol Br2充分反应,加水溶解后过滤,向滤液中通入 a mol Cl2。下列叙述不正确的是
A.当a=0.1时,发生的反应为:2Fe2++Cl2=2Fe3++2Cl-
B.当a=0.45时,发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.若溶液中Br-有一半被氧化时,c(Fe3+):c(Br-):c(Cl-)=l:1:3
D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
在t°C下,某反应达到平衡,平衡常数 。恒容时,温度升高,NO浓度减小。下列说法不正确的是
。恒容时,温度升高,NO浓度减小。下列说法不正确的是
A.该反应正反应的焓变为负值
B.恒温下扩大容器体积,反应体系的颜色不变
C.升高温度,逆反应速率增大
D.该反应化学方程式为NO2+SO2 NO+SO3
NO+SO3
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 取两只试管,分别加人4 mL 0.01 mol/L KMnO4酸性溶液,然后向一只试管中加入 0.1 mol/L H2C2O4溶液2 mL,向另一只试管中加入0.1 mol/L H2C2O4溶液 4 mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
B | 向含有酚酞的Na2CO3溶液中加入少量 Ba(OH)2固体,观察溶液颜色变化 | 证明Na2CO3溶液中存在水解平衡 |
C | 向10 mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的 Ksp:Mg(OH)2> Fe(OH)3 |
D | 测定相同条件等物质的量浓度的 Na2SO4溶液与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
下列关于实验的叙述,正确的是
A.滴定管的润洗是向滴定管中加入少量要盛装的溶液,边旋转边倾斜使溶液润湿全部内壁后从上口倒出
B.中和热的测定需要使用两个量筒分别量取酸醎溶液体积,使用两个温度计分别测定开始和终点的溶液温度
C.用质量分数为98%,密度为1.84 g/cm3的浓硫酸配制100 mL 2 mol/ L的稀硫酸,需要计算并称量浓硫酸的质量
D.用重结晶法提纯粗苯甲酸时,难溶性的杂质趁热过滤时留在了滤纸上,易溶的杂质冷却结晶时留在了母液里
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是
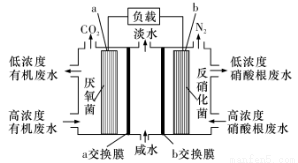
A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a 电极反应式: C6H10O5-24e-+7H2O==6CO2↑+24H+
D.a交换膜为阳离子交换膜
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
下列关于下图所示转化关系(X代表卤素)的说法错误的是

A.2H(g)+2X(g)==2HX(g) △H3<0
B.△H1=△H2+△H3
C.Cl、Br、I的非金属性依次减弱,所以按照途径I对应的△H1逐渐减小
D.途径I生成HC1放出的热量比生成HBr的多,说明HC1比HBr稳定
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
某磁黄铁矿的主要成分是FexS(S为一2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4 g、FeCl2 0.425 mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A.100 mL的盐酸中HC1物质的量浓度为7.5 mol/L
B.生成的H2S气体在标准状况下的体积为2.24 L
C.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3 : 1
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:选择题
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol/L的 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.开始加人合金的质量可能为16.4 g
B.产物NO的体积为2.24 L
C.参加反应的硝酸的物质的量为0.1 mol
D.生成沉淀完全时消耗NaOH溶液的体积为100 mL
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:实验题
某实验小组利用如下装置(部分固定装置略)制备氮化钙(CaxN2)并探究其实验式。

(1)按图连接好实验装置。检查装置的气密性,方法是_____________。
(2)反应过程中末端导管必须插入试管A的水中,目的是________________。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,__________;④拆除装置,取出产物。
(4)数据记录如下:
空瓷舟质量 m0/g | 瓷舟与钙的质量 m1/g | 瓷舟与产物的质景 m2/g |
14.80 | 15.08 | 15.15 |
① 计算得到实验式CaxN2,其中x=______________。
② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:________________。
查看答案和解析>>
科目: 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:简答题
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。下图是钒电池基本工作原理示意图:

请回答下列问题:
(1) 钒的氧化物是化学工业中最佳催化剂之一,有“化学面包”之称。已知钒原子的质子数为23,则钒在元素周期表中的位置是_____________。
(2) 钒电池是以溶解于一定浓度硫酸溶液中的不同种类的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极电极反应的活性物质,电池总反应为VO2++V3+ +H2O V2++VO2++2H+。放电时的正极反应式为______________,充电时,b为外界电源的_________极,充电时电池的负极反应式为______________。
V2++VO2++2H+。放电时的正极反应式为______________,充电时,b为外界电源的_________极,充电时电池的负极反应式为______________。
(3) 为保证电池稳定运行,“隔膜”选用质子交换膜,利用钒电池进行电解精炼铜,每得到64 g精铜,钒电池正负极电解液质量将相差__________g(水分子无法透过隔膜,假设原正负极电解液质量相同)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com