
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
α1和α2,c1和c2分别为两个恒容容器中平衡体系N2O4(g) 2NO2(g)和3O2(g)
2NO2(g)和3O2(g) 2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是
A.α1、α2均减小,c1、c2均增大
B.α1、α2均增大,c1、c2均减小
C.α1减小,α2增大,c1、c2均增大
D.α1减小,α2增大,c1增大,c2减小
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
有关下列图像的分析错误的是
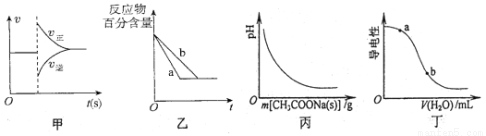
A.图甲可表示对平衡N2(g)+3H2(g) 2NH3(g)加压、同时移除部分NH3时的速率变化
2NH3(g)加压、同时移除部分NH3时的速率变化
B.图乙中a、b曲线可表示反应H2(g)十I2(g) 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
C.图丙表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
D.图丁表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:填空题
硫在空气中燃烧可以生成SO2,SO2在催化剂作用下可以被氧化为SO3,其热化学方程式可表示为:S(g) +O2(g)═SO2(g) △H=-297kJ/mol,SO2(g) + 1/2O2(g) SO3(g);△H =-98.3 KJ/mol。下图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量。
SO3(g);△H =-98.3 KJ/mol。下图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量。
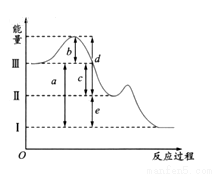
(1)Ⅰ→Ⅱ的反应是 (填“吸热”,“放热”)反应。
(2)c为 KJ。
(3)图示中b的大小对Ⅲ→Ⅱ反应的△H的影响是 。
A.△H随着b的增大而增大
B.△H随着b的增大而减小
C.△H随着b的减小而增大
D.△H不随b的变化而变化
(4)上图中的d+e-b= KJ。
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:填空题
请回答下列问题:
(1)纯水在T ℃时pH=6,该温度下1 mol/L的NaOH溶液中,由水电离出的c(OH-)= mol/L。
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A) pH(B) (填“>”、“=”或“<”);现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A) V(B)(填“>”、“=”或“<”)。
(3)已知:二元酸H2R 的电离方程式是:H2R=H++HR﹣,HR﹣ R2﹣+H+,若0.1mol•L﹣1NaHR溶液的c(H+)=a mol•L﹣1,则0.1mol•L﹣1H2R溶液中c(H+) (0.1
R2﹣+H+,若0.1mol•L﹣1NaHR溶液的c(H+)=a mol•L﹣1,则0.1mol•L﹣1H2R溶液中c(H+) (0.1 +a) mol•L﹣1(填“<”、“>”或“=”),理由是 。
+a) mol•L﹣1(填“<”、“>”或“=”),理由是 。
(4)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH[] | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________。
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:填空题
在容积为1 L的密闭容器中,加入1.0 mol A和2.2 mol B进行如下反应:A(g) + 2B(g)  C(g) + D(g),在800℃时,D的物质的量n(D)和时间t的关系如图。
C(g) + D(g),在800℃时,D的物质的量n(D)和时间t的关系如图。
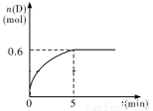
(1)800℃时,0~5 min内,以B表示的平均反应速率为____________。
(2)利用图中数据计算在800 ℃时的平衡常数的数值为___________。
(3)若700℃,反应达平衡时,A的浓度为0.55mol/L,则该反应为_________反应(填“吸热”或“放热”)。
(4)800 ℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol·L-1,c(B)=0.50 mol·L-1,c(C)=0.20 mol·L-1,c(D)=0.018 m ol·L-1,则此时该反应______________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
ol·L-1,则此时该反应______________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:实验题
定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:
(1)在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g•℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式(写出最后结果)△H=__________KJ/mol。
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6 kJ的热量。请写出表示该反应中和热的热化学方程式 。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为: (用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 (填“酸式”或“碱式”)滴定管中,达到滴定终点时的颜色变化为 。
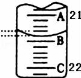
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为 mL。
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C= mol/L。
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:填空题
已知2A2(g)+B2(g) 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 mo
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 mo lA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
lA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达 到平衡时, A2的转化率为 。
到平衡时, A2的转化率为 。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将 (填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系:Q3= 。

(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容容器,起始时加入4 molA2和2 molB2,500 ℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4(填“>”、“<”或“=”)。
℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是 (填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
查看答案和解析>>
科目: 来源:2017届江西省高三上月考四化学试卷(解析版) 题型:选择题
已知:NA表示阿伏加德罗常数,则下列说法不正确的是
A.31g白磷分子中所含p—p共价键数目为1.5NA
B.标准状况下,2.24LD2中所含中子的数目是0.2NA
C.常温常压下42g乙烯和丙烯的混合气体含氢原子数目为6 NA
D.常温下,向1L0.2mol/L的盐酸溶液通入氨气,当溶液PH=7时,溶液中NH4+的数目小于0.2NA
查看答案和解析>>
科目: 来源:2017届江西省高三上月考四化学试卷(解析版) 题型:选择题
某离子反应中共有H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中c(ClO-) 随反应进行逐渐减小。下列判断错误的是( )
A.该反应的还原剂是NH4+
B.消耗1mol氧化剂,转移2mol电子
C.氧化剂与还原剂的物质的量之比是2:3
D.反应后溶液酸性明显增强
查看答案和解析>>
科目: 来源:2017届江西省高三上月考四化学试卷(解析版) 题型:选择题
下列实验现象预测不正确的是( )

A.实验Ⅰ:振荡后静置,上层溶液变为无色
B.实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com