
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
反应H2(g)+Cl2(g)═2HCl(g) 的发生过程能量变化如下所示:
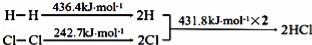
下列说法错误的是
A.H﹣H键比Cl﹣Cl键稳定
B.△H=﹣184.5 kJ•mol﹣1
C.正反应活化能比逆反应 活化能高
活化能高
D.在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时△H相同
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
已知反应 2NH3 N2 + 3H2,在某温度下的平衡常数为0.25,在此条件下,氨的合成反应1/2 N2 + 3/2 H2
N2 + 3H2,在某温度下的平衡常数为0.25,在此条件下,氨的合成反应1/2 N2 + 3/2 H2 NH3 的平衡常数为
NH3 的平衡常数为
A. 4  B.2 C.1 D.0.5
B.2 C.1 D.0.5
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
化学反应4A(s)+3B(g) 2C(g)+D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是
2C(g)+D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是
A.用A表示的反应速率是0.4 mol/(L•min)
B.2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的
C.2 min末的反应速率用B表示是0.3 mol/(L•min)
D.分别用B、C、D表示的反应速率其比值是3:2:1
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.增大反应物浓度可以增大活化分子百分数,从而使反应速率增大
B.汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能
C.常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0
D.在“中和热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即 盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度
盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
下列叙述正确的是
A.pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
B.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
C.液氯虽然不导电, 但溶解于水后导电情况良好,因此,液氯也是强电解质
但溶解于水后导电情况良好,因此,液氯也是强电解质
D. 溶液中c(H+)越大,pH也越大,溶液的酸性就越强
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
下列溶液一定呈酸性的是
A.pH=6.8的溶液
B.常温下,由水电离的OH﹣离子浓度为1×10﹣13mol/L
C.加入酚酞,不显红色的溶液
D.常温下,溶液中的H+离子浓度为5×10﹣7mol/L
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
在相同温度时,100 mL 0.01 mol/L的醋酸溶液与10 mL 0.1 mo l/L的醋酸溶液相比较,下列数值前者大于后者的是
l/L的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量 B.与Mg反应的起始速率
C.OH-的物质的量浓度 D.溶液中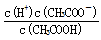
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.室温下用广范pH试纸测得某氯水的pH=4
B.将稀氯化铁溶液和稀硫氰化钾溶液混合,溶液呈浅红色,无论向其中加入浓氯化铁溶液还是浓硫氰化钾溶液,红色都会加深
C.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,滴定前仰视读数, 滴定后俯视读数会导致待测碱液浓度结果偏高
D.实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的间隔相同
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g) H2(g)+I2(g);则下列有关说法正确的是
H2(g)+I2(g);则下列有关说法正确的是
A.如改变体系温度,体系颜色一定发生变化
B.如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移
C.继续充入HI气体,则HI的转化率将减小
D.温度不变时 ,当体系颜色变浅,则正反应速率和逆反应速率都将减小
,当体系颜色变浅,则正反应速率和逆反应速率都将减小
查看答案和解析>>
科目: 来源:2016-2017学年天津市六校高二上学期期中化学卷(解析版) 题型:选择题
已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+=2Cr3+(绿色) + 6Fe3+ + 7H2O。
2H++ 2CrO42-(黄色)①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+=2Cr3+(绿色) + 6Fe3+ + 7H2O。
下列分析正确的是
A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B.实验②能说明氧化性:Cr2O72-> Fe3+
C.CrO42-和Fe2+在酸性溶液中可以大量共存
D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com