
科目: 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
能证明乙酸是弱酸的实验事实是
A、CH3COOH溶液与Zn反应放出H2
B、0.1mol/LCH3COONa溶液的pH大于7
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1mol/LCH3COOH溶液可使紫色石蕊变红
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
分别依据下列实验事实,得出的结论正确的是
实验事实 | 结论 | |
A | 将通入溴水中二氧化硫,溴水褪色 | 二氧化硫有漂白性 |
B | 淀粉与稀硫酸共热,再加银 | 淀粉没有水解 |
C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 向1mL 0.1 mol/L的AgNO3溶液中加入1 mL 0.1 mol/L NaCl溶液,出现白色沉淀,再加几滴0.1 mol/L Na2S溶液,有黑色沉淀生成 | 氯化银的溶解度大于硫化银 |
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
下列表达式正确的是
A.热化学反应方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)△H=-57.3kJ·mol-1
B.用碳电极电解CuSO4溶液离子反应方程式:2Cu2++2H2O 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
C.用电子式表示H2O中化学键形成过程:H2+O→H:O:H
D.过量的CO2通入NaAlO2溶液的化学方程式:2NaAlO2+CO2+3H2O=Al(OH)3↓+Na2CO3
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
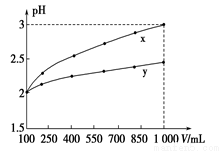
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
G20杭州峰会主题为“构建创新、活力、联动、包容的世界经济”,杭州为此次峰会大量引进了“钒电池”新能源公交车,“钒电池”的原理是利用钒的不同价态之间的转化,其充电原理可表示为2H+ + V2++ VO2+ = 2V3++ H2O,则下列说法不正确的是
A.阴极反应可表示为2H++VO2++e-=V3++H2O
B.阳极反应可表示为V2+-e-=V3+
C.放电过程种负极反应可表示为V3++2OH--e-=VO2++H2O
D.电解液体积为1L,pH=1,C(H+)=0.1mol/L;Ph=2;C(H+)=0.01mol/L;消耗氢离子的量为0.09mol;根据:2H++VO2++e-=V3++H2O关系:生成V3+的物质的量浓度为0.045mol/L
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g) 
 PCl3(g)+Cl2(g),下列说法正确的是
PCl3(g)+Cl2(g),下列说法正确的是
编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol•L-1•s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
将浓盐酸滴入KMnO4溶液,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。据此判断下列说法正确的是
A.滴加盐酸时,HCl是还原剂,Cl2是还原产物
B.已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性
C.若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.4NA
D.此实验条件下,物质的氧化性:KMnO4 > NaBiO3 > Cl2
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.NaHCO3溶液中溶质的电离方程式为NaHCO3===Na++H++CO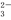
D.室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH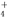 )·c(OH-)变大
)·c(OH-)变大
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:推断题
现有部分短周期主族元素的性质或原子结构如下表:
元素符号 | 原子结构和元素性质 |
T | M层上有6个电子 |
W | 短周期内原子半径最大 |
N | 原子序数比T小,且与T同主族 |
X | 最外层电子数是次外层的2倍 |
Y | 常见单质为双原子分子且氢化物的水溶液呈碱性 |
Z | 元素最高价为+7 |
(1)元素Z在周期表中的位置 ,XN2的结构式是: ,
(2)元素X的一种核素可测定文物年代,这种核素的符号是 ;
(3)在X、Y最低价的简单氢化物中,较稳定的化合物的分子式是 。
(4)将少量W2 N2固体投入到水中,剧烈反应,其反应的化学方程式为: 。
(5)下列表述中,能证明元素Z与元素T非金属性的强弱的是
A、常温下Z的单质和T的单质状态不同
B、Z的氢化物比T的氢化物稳定
C、一定条件下Z和T的单质都能与氢氧化钠溶液反
查看答案和解析>>
科目: 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:实验题
新切开的苹果在空气中放置一段时间表面会变黄,最终变成褐色,这种现象在食品科学上通常称为“褐变”。 关于苹果褐变的原因有以下两种说法:为____________
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究。
实验用品:苹果、浓度均为0.1mol·L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水。
(1)探究1:
实验操作 | 实验现象 | 结论 |
在“褐变”后的苹果上滴上2~3滴 溶液。 | _________________ | 说法A不正确 |
(2)探究2:【查阅文献】Ⅰ.苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5。Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色。
该小组将刚削皮的苹果切成七块,分别进行如下实验。请填写下表中相应的结论:
序号 | 实验步骤 | 现 象 |
|
① | 在一块上滴加2至3滴FeCl3溶液 | 表面变为绿色 | ______________ |
② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中。 | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化。 | 苹果褐变与_________有关 |
③ | 另两块分别立刻放入沸水和0.1mol·L–1盐酸中浸 | 相当长一段时间内,两块均无明显变化。 | 苹果褐变与酚氧化酶的活性有关 |
④ | 最后两块分别立刻放入浓度均为0.1mol·L–1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中。 | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化。 | 亚硫酸钠溶液能阻止苹果褐变 |
(3)问题分析:Ⅰ、常温下,浓度均为0.1 mol· L-1 NaHC O3溶液略显碱性,而NaHSO3溶液却略显酸性。 NaHSO3溶液略显酸性是因为 。
O3溶液略显碱性,而NaHSO3溶液却略显酸性。 NaHSO3溶液略显酸性是因为 。
Ⅱ、0.1mol· L–1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因 : 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com