
科目: 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:选择题
已知:(HF)2(g)  2HF(g) ΔH>0,且平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) ΔH>0,且平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
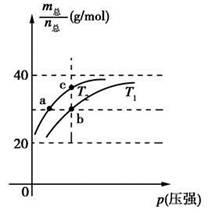
A.温度:T1<T2 B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:vb>va D.当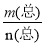 =30g·mol-1时,n(HF):n[(HF)2]=2:1
=30g·mol-1时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目: 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:选择题
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液退色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色退去
查看答案和解析>>
科目: 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:选择题
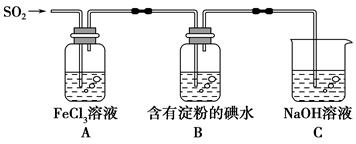
将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为
查看答案和解析>>
科目: 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:选择题
溶液X中含有右表中的某5种,且其浓度均为 0.1mol/L(不考虑水的电离与离子水解)。向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化。下列叙述不正确的是
阳离子 | Na+、Ca2+、Fe2+、Al3+、Fe3+、Mg2+ |
阴离子 | OH-、HCO3-、CO32-、Cl-、NO3-、SO42- |
A.X溶液中不可能含有HCO3-或CO32-
B.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+=3Fe3++NO+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
查看答案和解析>>
科目: 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:实验题
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液.向0.1mol·L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
实验二:向2mL FeCl2溶液中滴加2滴0.1mol·L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:________________。
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
Ⅲ.向2mL 0.1mol·L-1 FeCl3溶液中滴加2滴0.1mol·L-1KSCN溶液,变红,通入O2,无明显变化。
①实验I的说明__________________;
②实验Ⅲ的目的是____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)①甲直接用FeCl2·4H2O配制_________mol·L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去,进一步探究其原因:
②.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH约为3.由此,乙认为红色不褪去的可能原因是:____________________。
③.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i | 生成白色沉淀 | |
ii | 向i所得溶液中滴加0.1mol·L-1 FeCl3溶液 |
查看答案和解析>>
科目: 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:填空题
氨的化合物合成、应用及氨的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=akJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98kJ·mol-1
则a为______________。
(2)反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
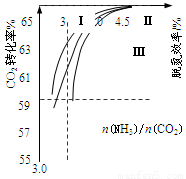
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A.0.6~0.7 B.1~1.1 C.1.5~1.61
生产中应选用水碳比的数值为 ___________(选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量大约为20%)。
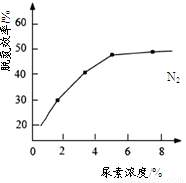
②下图是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为_________%。
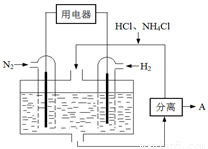
(4)下图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式___________________。生产中可分离出的物质A的化学式为 。
查看答案和解析>>
科目: 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:推断题
Ⅰ.已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性,A~I均为中学化学常见物质,它们之间的转化关系如图所示.(部分生成物和反应条件已略去)
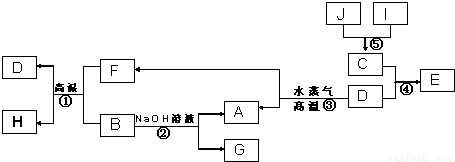
请回答下列问题:
(1)写出组成物质D的元素在周期表中的位置:_________________。
(2)写出反应②的化学方程式:___________________。
(3) J在H2O2分解反应中作催化剂.若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2价离子,该反应的离子方程式是___________________。
Ⅱ.某无色溶液,其中可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
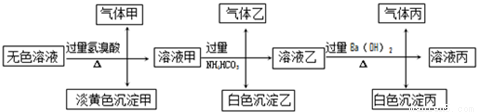
回答下列问题:
(4)生成沉淀甲的离子方程式:__________________;
(5)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
步骤 | 实验目的 | 试剂 | 现象 |
1 | |||
2 | |||
3 | |||
4 |
(6)针对溶液中可能存在的离子,用实验验证其是否存在的方法是_______________。
查看答案和解析>>
科目: 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:填空题
【化学-选修3:物质结构和性质】 砷的一些化合物常用作半导体、除草剂、杀鼠药等,回答下列问题:
(1)写出基态砷原子的电子排布式_________________;有_________________个未成对电子。
(2)稼氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大到小的顺序是____________;
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为______________,1mol As4O6含有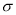 键的物质的量为____________mol。
键的物质的量为____________mol。

(4)As与N是同族元素,AsH3的沸点比NH3的沸点 ,原因是 。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比H3AsO3强的原因是: 。
(6)晶胞有两个基本要素
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子坐标参数A处Li为(0,0,1/2);B处As为(1/4,1/4,1/4);C处Li的坐标参数为 。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数,a=594pm,NA表示阿伏伽德罗常数的数值,其密度为 g•cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:推断题
【化学-选修5:有机化学基础】部分果蔬中含有下列成分,回答下列问题:
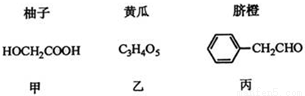
已知:
①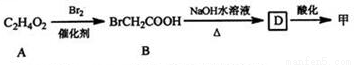
②1mol乙消耗NaHCO3的物质的量是甲的2倍
③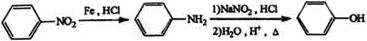
(1)甲可由已知①得到。
①甲中含有不饱和键的官能团名称为 ,可以表征有机化合物中存在任何官能团的仪器是 。
②A→B为取代反应,A的结构简式为 。
③B→D的化学方程式为 。
(2)乙在一定条件下生成链状脂类有机高分子化合物,该反应的化学方程式为 。
(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):
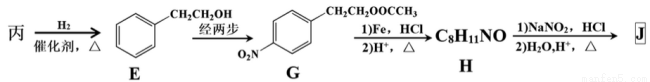
①检验丙中官能团的试剂是 ,反应的现象是 。
②经E→G→H保护的官能团是 ,据此推出E→G两步反应略去的反应物可能为:第一步 ,第二步 。
③J有多种同分异构体。其中某异构体L呈链状且不存在支链,L中的官能团都能与H2发生加成反应,L在核磁共振氢谱上显示为两组峰,峰面积比为3:2,则L的结构简式为 (只写一种)。
查看答案和解析>>
科目: 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:选择题
化学与人类生产、生活密切相关,下列说法正确的是( )
A.氮的固定是指将气态氮气变为固态
B.Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
C.金属可分为“黑色金属”和“有色金属”,铁及其合金都属于“有色金属”
D.包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com