
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
截止到2013年12月末,中国光伏发电新增装机容量达到10.66GW,光伏发电累计装机容量达到17.I6GW,图为光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是

A. N型半导体为正极,P型半导体为负极
B.制氢装置溶液中电子流向:从B极流向A极
C.X2为氧气
D.工作时,A极的电极反应式为CO(NH2) 2+8OH--6e-═CO32-+N2↑+6H2O
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,其在电解质储罐和电池间不断循环。下列说法不正确的是
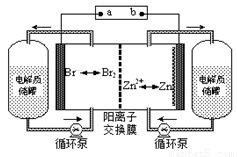
A.放电时负极的电极反应式为Zn-2e-=Zn2+
B.充电时电极a为电源的负极
C.阳离子交换膜可阻止Br2与Zn直接发生反应
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:填空题
在实验室模拟工业上以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
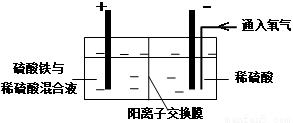
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 _____________。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_____________。(使用化学用语作答)
(2)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 _____________;加入有机萃取剂的目的是___________________。
(3)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 _____________。
(4)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ___________________。(忽略电解前后溶液体积的变化)
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:填空题
己知可逆反应AsO43-+2I-+2H+ AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。回答下列问题

(1)操作①过程中,C1棒为__________极,C2棒上发生的反应为______________________
(2)操作②过程中盐桥中的_________离子移向(I)烧杯,C1棒上发生的反应为_____________
(3)若将微安表换成电解冶炼铝装置,写出电解总反应方程式__________________________________
(4)若将微安表换成电解精炼铜装置,在操作②过程中与C2棒连接的为_________电极,电解一段时间后,溶液中CuSO4溶液的浓度_____________(填“变大”“变小”或“不变”)
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:填空题
I、铁及其化合物与生产、生活关系密切。
(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.
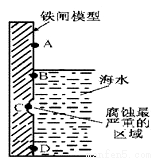
①该电化腐蚀称为___________。
②图中A、B、C、D四个区域,生成铁锈最多的是___________ (填字母)。
(2)己知:Fe(s)+O2(g)=FeO(s)H=-272.0kJ•mol-1
C(s)+O2(g)=CO2(g);△H=-393.5kJ•mol-1
2C(s)+O2(g)=2CO(g);△H=-221kJ•mol-1
则高炉炼铁过程中FeO(s)+CO Fe(S)+CO2(g) △H=____________。
Fe(S)+CO2(g) △H=____________。
II、甲醇是一种重要的化工原料和新型燃料。下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
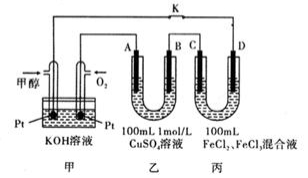
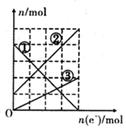
(1)甲中负极的电极反应式为_________________。
(2)乙中A极析出的气体在标准状况下的体积为_____________。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系右图,则图中②线表示的是_____________离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要_________________mL 5.0 mol•L-1 NaOH溶液。
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:填空题
已知:
酸 | H2C2O4 | HF | H2CO3 | H2BO3 |
电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
(1)为了证明HF是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究。
①甲同学取一定体积的HF溶液,滴入2滴紫色石蕊试液,显红色,再加入NaF固体观察到的现象是_______________,则证明HF为弱酸。
②乙同学取10ml未知浓度的HF溶液,测其pH为a,然后用蒸馏水稀释至1000ml。再测其pH为b,若要认为HF为弱酸,则a、b应满足的关系是b<_________(用含a的代数式表示)。
③丙同学用pH是指测得室温下0.10mol·L-1的HF溶液的pH为2,则测定HF为弱酸,由丙同学的实验数据可得室温下HF的电离平衡常数约为__________________。
(2)①已知H2BO3与NaOH溶液反应的离子方程式为H2BO3+OH-=B(OH)4,写出硼酸的电离方程式______________。
②向等浓度的H2C2O4与H2BO3混合溶液中逐滴加入NaOH溶液,则与OH-作用的粒子(包括分子和离子)依次为_____________,____________,____________。
③NaH C2O4溶液中加入少量的Na2CO3溶液,反应的离子方程式___________。
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:填空题
I.用惰性电极电解400 mL一定浓度的CuSO4溶液(不考虑电解过程中溶液体积的变化),通电一段时间后。
①若向所得溶液中加入0.1molCuO后,使溶液恰好恢复到电解前的浓度和pH,电解过程中总的离子反应方程式为_________。
②若向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为__________mol。
II.把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100mL的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则电路中共转移____________mol电子,此时铝元素以_____________形式存在。(用化学用语作答)
III.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。

(1) 若用NO2气体进行模拟电解法吸收实验。
① 写出电解时NO2发生反应的电极反应式:__________________。
② 若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+________mol。
(2) 某小组在右室装有10 L 0.2 mol·L-1硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 mol HNO3、0.1 mol HNO2,同时左室收集到标准状况下28 LH2。原气体中NO和NO2的体积比_____________。
查看答案和解析>>
科目: 来源:2016-2017学年内蒙古高一期中化学卷(解析版) 题型:选择题
下列各组分散系,可用丁达尔效应区分的是
A.溶液与浊液 B.两种不同胶体 C. 溶液与胶体 D.两种不同溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com