
科目: 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:选择题
在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol、b mol碘化氢(a>b),待反应2HI(g) I2(g) + H2(g)达平衡后,下列说法肯定正确的是()
I2(g) + H2(g)达平衡后,下列说法肯定正确的是()
A. 从反应开始到建立平衡的平均速率:vA<vB
B. 平衡时I2的浓度:c(I2)A=c(I2)B
C. 平衡时碘蒸气在混合气体中的百分含置:A容器大于B容器
D. 平衡时HI的分解率:αA=αB
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:选择题
向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀。另取等质最的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为( )
A. 7.84L B.6.72L C.4.48L D.无法计算
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:实验题
某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、 SO32-、SO42-、NO3-和NO2-等。为确定其组成,分别进行下列4组实验:
A.取试样,滴加适量的淀粉KI溶液,呈蓝色;
B.取试样,滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
C.取试样,滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
D.取试样,滴加酸性KMnO4溶液,不褪色。
请回答下列问题:
(1)其中能确认样品中不含SO32-的实验操作是______________(填实验操作序号);
(2)根据实验结果,你认为是否含有NO2-?___________(填“含有”、“不含有”),其原因是_______________;
(3)写出A实验现象的离子方程________________;
(4)C实验说明酸雨中含________________。
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:实验题
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
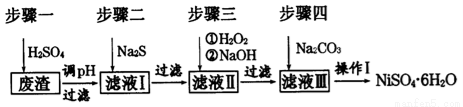
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取速率可采取的措施有_____________(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:_______________。
(3)上述流程中滤液Ⅲ的主要成分是___________。
(4)确定步骤四中Na2CO3溶液足量,碳酸镍己完全沉淀的简单实验方法是______________。
(5)操作I的实验步骤依次为(实验中可选用的试剂:溶液、蒸馏水、pH试纸):
①_______________;
②_______________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体
④ 用少量乙醇洗涤NiSO4·6H2O晶体并晾干
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:填空题
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g)  2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:

(1)上图中属于氢气物质的量随时间变化的曲线是 (填“I”、“II”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是
A.t2时该反应达到平衡状态
b.t2时II和III代表的物质反应速率相同
c.t2时氢气、氮气与氨气的反应速率之比为3:1:2
D.t2时氨气与氢气的物质的量相同
(3)对于II所代表的物质,其逆反应速率最大的点是__________(填“c”、“d”或“g”);对于I所代表的物质,其正反应速率最小的点是___________ (填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是____________(填序号)
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,—定条件下建立平衡:N2(g) + 3H2(g)  2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:实验题
研究硫元素及其化合物的性质具有重要意义。
I.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)
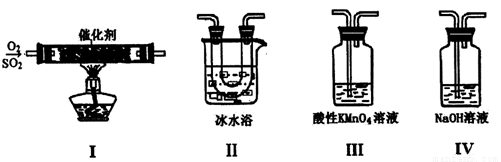
(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_________;装置III中溶液逐渐褪色,证明二氧化硫具有___________性。
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40 mL 3.0mol/L NaOH溶液,反应后增重5.12 g,则装置Ⅳ中发生反应的化学方程式是_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
A.硫化钠溶液 B.氨水 C.盐酸 D.硝酸钾溶液
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(4)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(填序号)。
a.KSCN溶液和氯水 b.氢氧化钠溶液
c.酸性KMnO4溶液 d.铁粉和KSCN溶液
(5)乙同学取784mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积百分数为____________。(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体,产生CO2的理由是_______________(用化学方程式表示)
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
电池是人类生产和生活的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大
D.太阳能电池的主要材料是高纯度的二氧化硅
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
下列叙述中,不能用勒夏特列原理解释的是
A.配制FeCl3溶液时加入少量的浓盐酸
B.常温下,NaOH溶液中由水电离出的C(H+)<1×10-7mol/L
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中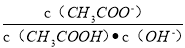 增大
增大
C.向盐酸中加入氨水至中性,溶液中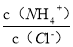 >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不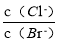 变
变
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
下列用来表示物质变化的化学用语中,正确的是
A.用铁电极电解NaNO3溶液的阳极反应式:4OH--4e-=O2+2H2O
B.HS-的水解方程式:HS-+H2O S2-+H3O+
S2-+H3O+
C.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++H++SO42-
D.用惰性电极电解AlCl3溶液的总反应离子方程式:2Cl-+2H2O H2↑+ Cl2↑+2OH-
H2↑+ Cl2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com