
科目: 来源: 题型:
 (2011?焦作一模)在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2SO2(g)+O2(g)
(2011?焦作一模)在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2SO2(g)+O2(g) 2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:
2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molSO21molO2 | 2molSO3 | 4molSO22molO2 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
| c |
| 2 |
| c |
| 2 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
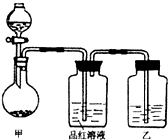 某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
| ||
 CO2↑+2SO2↑+2H2O)
CO2↑+2SO2↑+2H2O)
| ||
 CO2↑+2SO2↑+2H2O)
CO2↑+2SO2↑+2H2O)| 实验操作 | 预期现象和结论 |
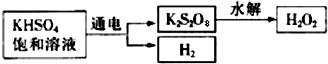
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
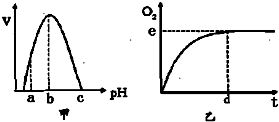 图甲是H202酶活性受pH影响的曲线,图乙表示在最适温度下,pH=b时H202分解产生的O2量随时间的变化.若该酶促反应过程中改变某一初始条件,以下叙述正确的是( )
图甲是H202酶活性受pH影响的曲线,图乙表示在最适温度下,pH=b时H202分解产生的O2量随时间的变化.若该酶促反应过程中改变某一初始条件,以下叙述正确的是( )查看答案和解析>>
科目: 来源: 题型:
 2C(g),压强一定时,测得在平衡时C的体积分数为0.4.
2C(g),压强一定时,测得在平衡时C的体积分数为0.4.查看答案和解析>>
科目: 来源: 题型:
 CO2+H2,达到平衡时,
CO2+H2,达到平衡时,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com