
科目: 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:选择题
在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下 列数值中,前者大于后者的是( )
列数值中,前者大于后者的是( )
A.H+ 的物质的量 B. 醋酸的电离常数
C.中和时所需NaOH的量 D. H+的物质的量浓度
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:选择题
在一定温度下,有A.盐酸 b.硫酸 c.醋酸三种酸,下列说法正确的是( )
A.等物质的量浓度的三种酸的pH由大到小的关系为b>a>c
B.等物质的量浓度等体积的三种酸,与等浓度的NaOH溶液反应,消耗碱的体积 由大到小的顺序是a=b=c
由大到小的顺序是a=b=c
C.三者pH相同、体积相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是c>a=b
D.三者pH相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则三者的初始反应速率大小关系为b >a>c
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:选择题
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L 盐酸和20.00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。若以HA表示酸,下列说法正确的是( )
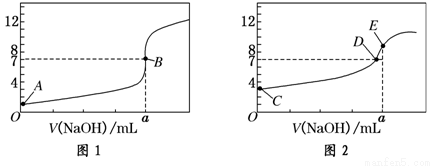
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+) = c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0 mL< V(NaOH) <20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A—) >c(Na+)> c(H+) > c(OH—)
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:选择题
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图,下列说法正确的是( )
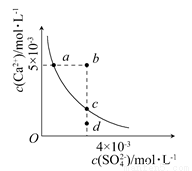
A.在任何溶液中,c(Ca2+)、c(SO42—)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42—)一定等于3×10-3mol·L-1
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:选择题
下列关于电解质溶液的叙述 正确的是 ( )
正确的是 ( )
A.常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+)
B.稀释醋酸溶液,溶液中所有离子的浓度均降低
C.在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-)
D.0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:选择题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH)=0时,c(H+)=0.01 mol•L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:填空题
( 14分)
I .(1)已知H2的燃烧热285.8KJ/mol,写出液态水电解生成H2和O2的热化学方程式 ;
(2)已知2SO2(g)+O2(g) = 2SO3(g) ΔH=-197 kJ/mol,相同温度和压强条件下,4molSO2和2molO2充入容器中反应至平衡时放出的能量为Q KJ,则Q 394KJ(填“>”“<”或“=”)
II.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g) CH3OH
CH3OH (g)+H2O(g) ΔH1
(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
(1)由表中数据判断ΔH2 0(填“>”、“<”或“=”),
(2)若容器容积不变,下列措施可增加甲醇产率的是 ,
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.恒温恒容充入He,使体系总压强增大
E.按原比例再充入 CO和 H2
(3)某温度下,将2 mol CO和6 mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择);
(4)恒温下,1mol CO和nmol H2在一个容积可变的密闭容器中反应达到平衡后,生成a molCH3OH.若起始时放入3molCO+3nmolH2,则达平衡时生成CH3OH_______mol。
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:实验题
某学生用中和滴定法测定某烧碱样品的纯度。先准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液。用0.200mol/L的盐酸标准液滴定待测液,滴定时用酚酞做指示剂。试根据实验回答下列问题:
(1)下列有关滴定操作的顺序正确的是
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.③⑤②①④ D.②①③⑤④
(2)用标准的盐酸滴定待测的NaOH溶液时,一手握酸式滴定管的活塞,一手摇动锥形瓶,眼睛注视_________,本实验滴定达到终点的标志是_________________________。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是 ,烧碱样品的纯度是___________
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前刻度(mL) | 滴定后刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
第三次 | 10.00 | 0.20 | 24.20 |
(4)若该实验修改成“用待测碱液滴定盐酸标准液”,则下列操作会使烧碱样品纯度偏高的是
A.锥形瓶用蒸馏水洗净后,先用盐酸标准液润洗再装标准液。
B.碱式滴定管用蒸馏水洗净后未润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前仰视碱式滴定管读数,滴定后俯视滴定管读数
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:填空题
25 ℃时,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
回答下列问题:

(1)下列反应不能发生的是: ;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(2)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如右上图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,写出HX的电离方程式 。
(3)某温度下,纯水中c (H+)=2.0×10-7 mol·L?1, 0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合后(不考虑溶液体积变化),溶液的pH= 。
(4)等浓度等体积的CH3COONa和NaCN混合后,所得混合溶液中各离子浓度的大小关系是: 。
(5)某二元酸H2B在水中的电离方程式为H2B = H+ + HB— ;HB— H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:实验题
某废液是用稀硝酸腐蚀锌板后得到的 ,某化学兴趣小组拟用该废液(含有少量的Cl-、Fe3+)制取Zn(NO3)2·6H2O的过程如下:
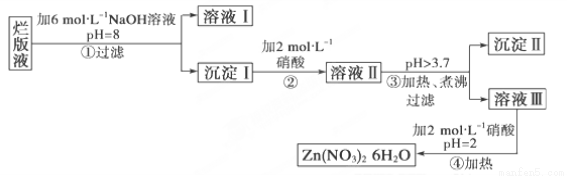
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物Zn(OH)2具有两性,Fe3+在PH=3.7时就能完全沉淀。
(1)该废液溶质的主要成分是________(填化学式)。
(2)在操作①中保持pH=8的目的是______________________。
(3)沉淀Ⅰ的成分是___________________________。
(4)操作③中加热、煮沸的目的是________________________;
(5)操作④保持pH=2的目的是__________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com