
科目: 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
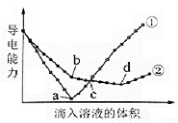
下列分析不正确的是
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目: 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
锌?空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)42-。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液
 中C(OH-)逐渐减小
中C(OH-)逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–=Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目: 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
下列有关电解质溶液的说法正确的是
A.向0.1mol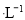 CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中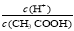 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中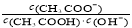 增大
增大
C.向盐酸中加入氨水至中性,溶液中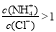
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中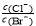 不变
不变
查看答案和解析>>
科目: 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
查看答案和解析>>
科目: 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
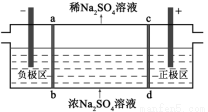
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O ? 4e– = O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目: 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:填空题
汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源:
(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol﹣1,其能量变化示意图如下: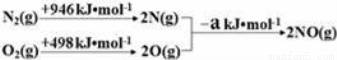
则NO中氮氧键的键能为 kJ•mol﹣1;
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行 ,并说出理由
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=﹣b kJ•mol﹣1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是 ;
A.增加排气管长度 B.增大尾气排放口 C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
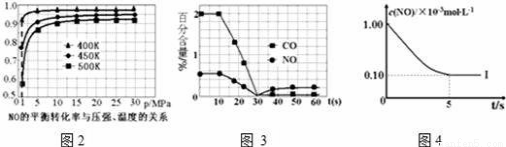
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是 ;
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是 ;
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
实验编号 | T(K) | NO初始浓度 (mol•L﹣1) | CO初始浓度 (mol•L﹣1) | 催化剂的比表面积 (m2/g) |
Ⅰ | 400 | 1.00×10﹣3 | 3.60×10﹣3 | 82 |
Ⅱ | 400 | 1.00×10﹣3 | 3.60×10﹣3 | 124 |
Ⅲ | 450 | 1.00×10﹣3 | 3.60×10﹣3 | 124 |
根据坐标图4,计算400K时该反应的平衡常数为 ;
查看答案和解析>>
科目: 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:填空题
在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g) 2NH3(g) △H2=-92.4kJ/mol ,有关数据及特定平衡状态见下表。
2NH3(g) △H2=-92.4kJ/mol ,有关数据及特定平衡状态见下表。
容器 | 起始投入 | 达平衡时 | ||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 |
乙 | amolN2 | bmolH2 | 0molNH3 | 1.2molNH3 |
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为 ,起始时乙中的压强是甲容器的 倍,乙的平衡常数为
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是 (选填序号)。
a | b | c | d | |
x | 温度 | 温度 | 加入H | 加入氨气的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影 响,实验结果如图所示(图中T表示温度,n表示物质的量):
响,实验结果如图所示(图中T表示温度,n表示物质的量):
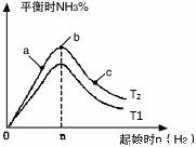
像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
②a、b、c三点中,N2转化率最高的是 (填字母)。
③若容器容积为1L,T2℃在起始体系中加入1molN2,3molH2,经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为 。保持容器体积不变,若起始时向容器内放入2molN2和6molH2,达平 衡后放出的热量为Q,则Q_________110.88kJ(填“
衡后放出的热量为Q,则Q_________110.88kJ(填“ >”、“<”或“=”)。
>”、“<”或“=”)。
查看答案和解析>>
科目: 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:填空题
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
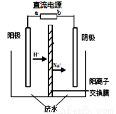
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:① 4OH--4e-=O2↑+2H2O② 。
阴极:① 。②CH3CHO+2e-+2H2O=CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填字母序号)。
a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO 42-)+c(CH3COO-)+c(OH-)
42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)高纯度氧化铝是用于制备隔膜的材料,某研究小组用以下流程制取高纯度氧化铝:
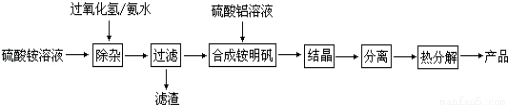
①“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
②配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
③“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
查看答案和解析>>
科目: 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:填空题
有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH |
阴离子 | CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是_____________,B是____________(填化学式) 。用离子方程式表示A的水溶液中存在的平衡关系: 。
(2)25 ℃时,0.1 mol ·L-1 B溶液的pH=a,则B溶液中:c(H+)-c(OH—)=_____________(填微粒浓度符号)=_____________(用含有a的关系式表示)。
·L-1 B溶液的pH=a,则B溶液中:c(H+)-c(OH—)=_____________(填微粒浓度符号)=_____________(用含有a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_____________。
(4)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _____。
(5)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl?,利用Ag+与CrO42?生成砖红色沉淀,指示到达滴定终点。当溶液中Cl?恰好沉淀完全(浓度等于1.0×10?5 mol·L?1)时,溶液中c(Ag+)为_______ mol·L?1,此时溶液中c(CrO42?)等于__________ mol·L?1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10?12和2.0×10?10)。
(6)现使用酸碱中和滴定法测定酸的浓度。在本实验的滴定过程中,下列操作会使实验结果偏大的是 (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测酸溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目: 来源:2017届安徽师大附中高三上新课标模拟化学卷(解析版) 题型:选择题
化学与生活密切相关,下列说法正确的是
A.氟利昂作制冷剂会加剧雾霾天气的形成
B.计算机芯片的材料是二氧化硅
C.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D.“轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com