
科目: 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列关于生活中的一些做法不科学的是 ( )
A.用SO2漂白纸 浆和草帽
浆和草帽
B.Al(OH)3用于治疗胃酸过多
C.用小苏打发酵面团制作馒头
D.用较浓的氢氧化钠溶液洗涤衣服上的油污
查看答案和解析>>
科目: 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol·L-1的NaHCO3溶液中,含有HCO3-与CO32-的数目之和为0.1 NA
B.0.1mol•L-1 Na2SO3溶液中:c(Na+)+c(H+)=2c(SO3 2-)+c(HSO 3-)+c(OH-)
C.等浓度的系列稀溶液:①硫酸氢钠、②乙酸钠、③醋酸、④碳酸氢钠、⑤硝酸钾、⑥苯酚钠、⑦氢氧化钠、⑧硫酸,它们的PH由小到大排列的为①③⑤②⑥④⑦⑧
D.25℃,由水电离出的C(H+)=1×10-12 mol·L-1 的溶液中以下离子Na+、NH4+、I-、NO3-一定能大量共存
查看答案和解析>>
科目: 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:选择题
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶【解析】
再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀盐酸有气泡产生,震荡后仍有固体存在。
该白色粉末可能为( )
A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3 C.Na2SO3、BaCO3 D.Na2CO3、CuSO4
查看答案和解析>>
科目: 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:选择题
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3=Na++H++CO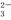
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)=2[c(CO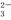 )+c(HCO
)+c(HCO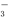 )+c(H2CO3)
)+c(H2CO3)
D.温度升高,c(HCO )增大
)增大
查看答案和解析>>
科目: 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:选择题
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH CH3COO-+H
CH3COO-+H + K1=1.75×10-5
+ K1=1.75×10-5  △H1>0
△H1>0
CH3COO-+H2O CH3COOH+OH- K2=5.71×10-10 △H2>0
CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,则下列叙述正确的是( )
A.对混合溶液进行微热,K1增大、K2减小
B.混合溶液的pH>7
C.温度不变,若在混合溶液中加入少量NaOH固体,则c(CH3COO-)减小
D.混合溶液中c(CH3COO-)>c(Na+)
查看答案和解析>>
科目: 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.HA比HB更难电离,则NaA比NaB的水解能力更强
B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多
D.常温下,向10 mL pH=12的氢氧化钠溶液中加入pH=2的HCl至pH=7,所得溶液的总体积>20 mL
查看答案和解析>>
科目: 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:填空题
下图表示氮及其化合物在一定条件下的转化关系:
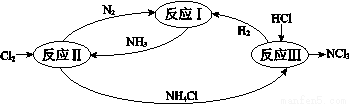
(1)根据反应I,在500℃、20MPa时,将N2和H2通入到 体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:
体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:
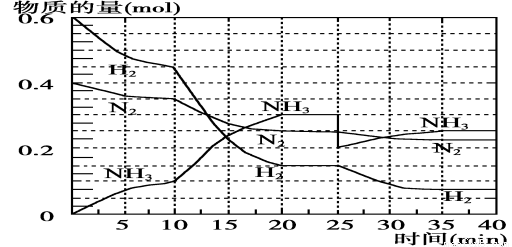
(1)10 min内用NH3表示该反应的平均速率,v(NH3)= 。
(2)在10~20min内NH3浓度变化的原因可能是 (填字母)。
a.加了催化剂
b.降低温度
c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是_______(填字母)。
a.3v(H2)正 = 2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d. N2、H2、NH3的分子数之比为1∶3∶2
(4)第一次平衡时,平衡常数K1= (用数学表达式表示)。
(5)反应I:N2(g)+3H2(g) 2NH3(g) ΔH=–92.4 kJ•mol-1
2NH3(g) ΔH=–92.4 kJ•mol-1
如图所示反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是____________(填“温度”或“压强”),判断L1、L2的大小关系并说明理由_______ 。

(6)反应II其中一步反应为
2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJ•mol-1
已知: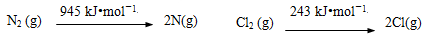
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为_________ kJ。
查看答案和解析>>
科目: 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:填空题
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,用离子方程式表示原因_____________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的作用是_________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。向饱和NaClO溶液中加入饱和KAl(SO4)2溶液,产生 大量的白色胶状沉淀。反应的离子方程式是_______________________。
大量的白色胶状沉淀。反应的离子方程式是_______________________。
(4)常温下,pH=11的NaClO溶液中,水电离出来的c(OH-)=________,在pH=3的HClO溶液中,水电离出来的c(H+)=____________________________。
(5)已知纯水中存在如下平衡:H2O+H2O H3O++OH- ΔH>0,现欲使平衡向右移动,且所
H3O++OH- ΔH>0,现欲使平衡向右移动,且所 得溶液显酸性,可选择的方法是________(填字母)。
得溶液显酸性,可选择的方法是________(填字母)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.向水中加入(NH4)2SO4固体
(6)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________n(填“<”、“>”或“=”)。
(7) 在25 ℃时,将0.2 mol NaA晶体和0.1 mol HA气体同时溶解于同一烧杯的水中,制得1 L溶液,则c(HA)+c(A-)= mol·L-1
查看答案和解析>>
科目: 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:填空题
过氧化氢其水溶液适用于医用伤口消毒及环境消毒和食品消毒。
Ⅰ.过氧化氢性质实验
(1)酸性条件下H2O2可将水中的Fe2+转化成Fe3+,由此说明H2O2具有___________性。请写出该反应离子方程式: 。
(2)已知H2O2是一种二元弱酸,其中Ka1=1.0×10-12、Ka2=1.05×10-25;则H2O2的电离方程式为 ,常温下1mol·L-1的 H2O2溶液的pH为 。
H2O2溶液的pH为 。
Ⅱ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO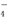 +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
(3)滴定到达终点的现象是____________________。
(4)用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为__________mol·L-1。
(5)若滴定前尖嘴中有气泡,滴定后消失,则测定结果________(“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com