
科目: 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:选择题
25℃时,下列溶液中微粒的 物质的量浓度关系正确的是
物质的量浓度关系正确的是
A.0.l mol·L﹣lNaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣)
B.0.l mol·L﹣1NaHS溶液:c(OH﹣) + c(S2﹣)=c(H+) + c(H2S)
C.0.l mol·L﹣1CH3COOH 溶液和0.l mol·L﹣1CH3COONa 溶液等体积混合:
c(Na+)>c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(OH﹣)
D.0.l mol·L﹣lNH4HSO4 溶液中滴加0.l mol·L﹣1NaOH溶液至中性:
C(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)
查看答案和解析>>
科目: 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:选择题
一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
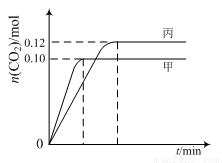
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A.该反应的正反应为吸热反应
B.达到平衡时,乙中CO2的体积分数比甲中的小
C.T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)>v(逆)
D.T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目: 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:实验题
某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:
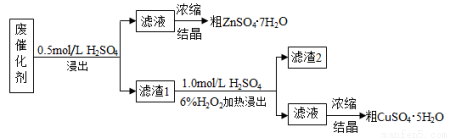
已知:ZnS与稀硫酸反应,且化合价不变;CuS不与稀硫酸反应。回答下列问题:
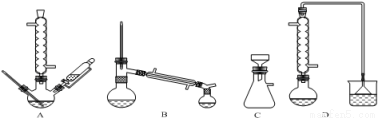
(1)在下列装置中,第一次浸出必须用 。(填标号)
(2)第二次浸出时,向盛有滤渣1的反应器中先加入稀H2SO4,后滴入H2O2溶液。
①写出第二次浸出(有单质生成)的化学方程式 。
②若滴加H2SO4和H2O2顺序相反,会造成 。
③滤渣2的主要成分是 。
CuS+H2O2+H2SO4=CuSO4+S+2H2O
(3)浓缩硫酸锌、硫酸铜溶液使用的主要仪器名称是 。
(4)该同学在实验完成之后,得到1.50g CuSO4·5H2O,则铜的回收率为 。
查看答案和解析>>
科目: 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:填空题
化合物G是生命合成核酸的必需前体物质,对机体免疫功能和修复具有重要作用。化合物G 的一种合成路线如下:
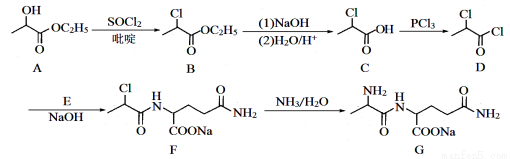
(1)化合物A中含氧官能团的名称为 和 。
(2)化合物E的分子式为C5H10O3N2,其结构简式为 ;由F→G的反应类型为 。
(3)一定条件下F可转化为H(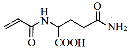 ),写出同时满足下列条件的H的一种同分异构体的结构简式 。
),写出同时满足下列条件的H的一种同分异构体的结构简式 。
①能与FeCl3溶液发生显色反应; ②能与盐酸反应; ③分子中只含有3种不同化学环境的氢。
(4)已知:①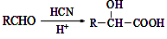 ②
②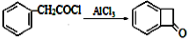 。请写出以
。请写出以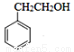 为原料制备
为原料制备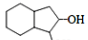 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:实验题
某研究小组同学通过下列流程制取不溶于水和稀硫酸的黄钾铵铁矾[KNH4Fex(SO4)y(OH)z],并通过实验测定样品中黄钾铵铁矾的有关组成。
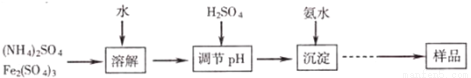
实验测定:
①称取一定质量的样品加入稀盐酸中充分溶解,将所得溶液转移至容量瓶并配制成l00mL溶液A;
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g;
③量取25.00mL溶液A,加入足量KI,用2.000mol·L﹣1Na2S2O3溶液进行滴定(已知反应为I2+2Na2S2O3═2NaI+Na2S4O6,消耗30.00mL Na2S2O3溶液至终点。
(1)在[KNH4Fex(SO4)y(OH)z]中x、y、z的代数关系式为 。
(2)若加入H2SO4将pH调节为2,则溶液c(Fe3+)应为 mol·L﹣1。(已知Ksp[Fe(OH)3]=4.0×10﹣38)
(3)实验测定②中检验沉淀是否完全的方法是 。
(4)根据以上实验数据计算样品中的n(Fe3+)∶n(SO42﹣)。(写出计算过程)
查看答案和解析>>
科目: 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:实验题
实验室用下图所示装置制备AlCl3溶液,并用AlC l
l 3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后煅烧沉淀制备新型的超导材料和发光材料七铝十二钙(12CaO·7Al2O3)。已知AlCl3易水解,易升华。
3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后煅烧沉淀制备新型的超导材料和发光材料七铝十二钙(12CaO·7Al2O3)。已知AlCl3易水解,易升华。
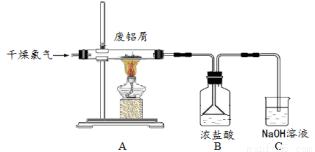
(1)实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为  ;C装置的作用 。
;C装置的作用 。
(2)氯气与废铝屑反应生成的AlCl3蒸气溶解在B中浓盐酸,为了防止AlCl3蒸气凝华堵塞 导管,实验中可采取的措施是 (写出一点)。
导管,实验中可采取的措施是 (写出一点)。
(3)AlCl3溶液溶解CaCO3时,AlCl3 溶液和碳酸钙粉末的混合方式为 。
溶液和碳酸钙粉末的混合方式为 。
(4)实验要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 。
(5)用白云石(主要成分为CaCO3、MgCO3)制备纯净碳酸钙的实验方案为:将一定量的白云石煅烧, 。(实验中需用到的试剂有:硝酸铵溶液,氨气,二氧化碳;需要用到的仪器:pH计。已知:镁的化合物不溶于硝酸铵溶液;pH值为11~12时得到较纯净碳酸钙沉淀)。
查看答案和解析>>
科目: 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:填空题
数十年来,化学工作者对碳的氧化物做了广 泛深入的研究并取得了一些重要成果。如利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
泛深入的研究并取得了一些重要成果。如利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
I.CH4(g)=C(s)+2H2(g) ΔH= + 75.0 kJ·mol-1
II.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH = + 41.0 kJ·mol-1
III.CO(g)+H2(g)=C(s)+H2O(g) ΔH = -131.0 kJ·mol-1
(1)反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH = kJ·mol-1。
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。
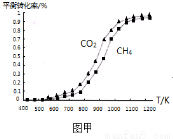
同温度下CO2的平衡转化率 (填“大于”或“小于”)CH4的平衡转化率,其原因是 。
②高温下进行该反应时常会因反应I生成“积碳”(碳单质),造成催化剂中毒,高温下反应I能自发进行的原因是 。
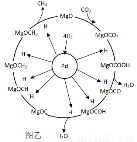
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图乙所示,该反应的化学方程式为 。
(4)CO常用于工业冶炼金属,右图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。下列说法正确的是 。(填序号)
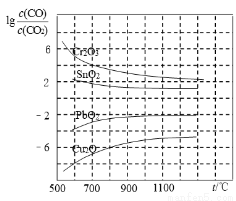
A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D.CO还原PbO2的反应ΔH>0
(5)在载人航天 器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:
器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为: 2CO2
2CO2 2CO+O2,则其阳极的电极反应式为 。
2CO+O2,则其阳极的电极反应式为 。
查看答案和解析>>
科目: 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:填空题
【物质结构与性质】钛被称为“国防金属”和“生物金属”,是重要的结构材料。
(1)基态钛原子的核外电子排布式是 。
(2)金红石(TiO2)的熔点1825℃,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是 晶体。
(3)TiCl4能与NH4Cl反应生成配合物(NH4)2[TiCl6]。
①此配合物中,形成配位键时提供孤对电子的有 。(填元素符号)
②与NH4+互为等电子体的一种阴离子为 。(填化学式)
(4)TiO2+与H2O2在稀酸中反应生成橘红色的[TiO(H2O2)]2+离子,可用于钛的定性检验。下列关于H2O2的说法正确的是 。(填序号)
A.空间构型为直线形 |
B.含非极性键的极性分子 |
C.O原子轨道杂化类型为sp3 |
D.化学性质不稳定是因为氢键的键能较小 |
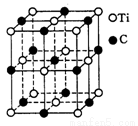
(5)最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,结构模型如图所示,它的分子式为 。
查看答案和解析>>
科目: 来源:2017届宁夏高三上月考四化学卷(解析版) 题型:选择题
化学与生活息息相关,下列说法不正确的是( )
A.乙烯可作为水果的催熟剂
B.地沟油经过处理,可用来制造肥皂
C.漂白粉长期暴露在空气中会变质失效
D.煤炭燃烧过程安装固硫装置,可有效提高煤的利用率
查看答案和解析>>
科目: 来源:2017届宁夏高三上月考四化学卷(解析版) 题型:选择题
若以NA代表阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol Na 跟足量H2O反应得到电子的数目为NA
B.常温常压下,16 g甲烷(CH4)所含电子数为NA
C.标准状况下,22.4 L 酒精所含的分子数目为NA
D.常温常压下,6 g O2和26 g O3混合气体中的原子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com