
科目: 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:选择题
在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是
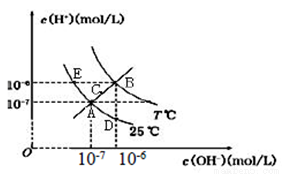
A.图中五点Kw间的关系:B>C>A=D=E
B.E点对应的水溶液中,可能有NH4+、Ba2+、Cl-、I-大量同时存在
C.若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有: c(HA-)>c(OH-)>c(A2-)>c(H2A)
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A点所示,则溶液中反应:2H+ + SO42- + Ba2+ + 2OH- = BaSO4↓+ 2H2O
查看答案和解析>>
科目: 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:实验题
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒。某兴趣小组进行下面实验探究,查阅资料知道:
①HNO2为弱酸,
②2NO+Na2O2=2NaNO2,
③2NO2+Na2O2=2NaNO3
④酸性KMnO4溶液可将NO和NO2-均氧化为NO3-,MnO4-还原成Mn2+。
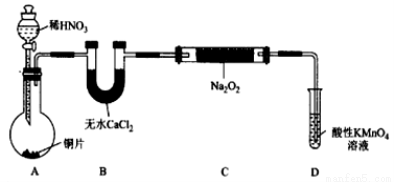
NaNO2的制备方法可有如下2种方法(夹持装置和加热装置已略,气密性已检验):
制备装置1:
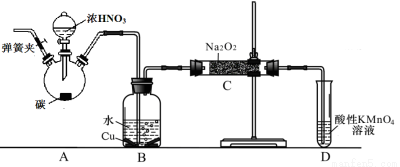
制备装置2:
(1)在制备装置1中:
① 如果没有B装置,C中发生的副反应有 ;
② 甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质;于是在A装置与B装置间增加了 装置,改进后提高了NaNO2的纯度;
③ D装置发生反应的离子方程式为 。
(2)在制备装置2中:
① B装置的作用是 ;
② 写出装置A烧瓶中发生反应的化学方程式并用单线桥标出电子的转移 ;
③ 为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为 ;
④ 实验经改进后可制得较纯亚硝酸钠,下列关于亚硝酸钠的说法正确的是________。
a.亚硝酸钠有咸味,可代替食盐食用
b.常温下,0.1mol/L亚硝酸钠溶液pH>1
c.0.1mol/L亚硝酸钠溶液中存在:c(Na+)+c(H+)=c(NO2-)+c(OH-)
d.0.1mol/L亚硝酸钠溶液中存在:c(NO2-)>c(Na+)>c(OH-)>c(H+)
⑤ 试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论) 。
查看答案和解析>>
科目: 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:实验题
下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程能得到常用的单质、聚铁(碱式硫酸铁的聚合物)、铁红(Fe2O3)和绿矾(FeSO4·7H2O)。
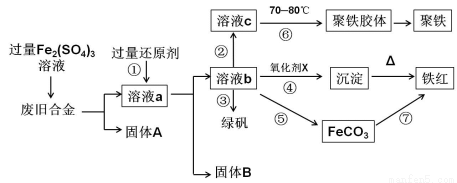
(1)加入过量Fe2(SO4)3溶液过程中与较活泼的金属反应的离子方程式: 。
(2)①中过量的还原剂应是 ,固体B是 。
(3)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
(4)②中加入H2O2,并调节pH值得到溶液c,在⑥中,将溶液c控制到70~80 ℃的目的是 。
(5)在③中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有 。
(6)在④中的氧化剂X是 。
(7)在⑤中,向溶液b加入了NH4HCO3溶液,得到FeCO3沉淀,写出其离子反应方程式: 。
(8)在⑦中,写出FeCO3煅烧的化学反应方程式: 。
查看答案和解析>>
科目: 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:填空题
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染。
(1)已知:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
③CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H3= 。
N2(g)+CO2(g)+2H2O(g) △H3= 。
(2)反应③在热力学上趋势很大,其原因是 。在固定容器中按一定比例混合CH4与NO2后,提高NO2转化率的反应条件是 。
(3)在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应③,测得有关数据如下表:
实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
① 开展实验1和实验2的目的是 。
② 130℃时,反应到20分钟时,NO2的反应速率是 。
③ 180℃时达到平衡状态时,CH4的平衡转化率为 。
④ 已知130℃时该反应的化学平衡常数为6.4,试计算a= 。
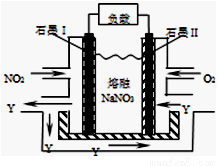
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。该电池在使用过程中石墨I电极上生成氧化物Y,该电极反应为 。
查看答案和解析>>
科目: 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)C2H2 分子中,共价键的类型有 ,C 原子的杂化轨道类型是 ,写出两个与C2H2具有相同空间构型含碳无机物分子的分子式 。
( 4 )CO 能与金属Fe、Ni分别形成Fe(CO)5、Ni(CO)4,Fe(CO)5中Fe元素的原子核外电子排布为 ,Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO)4是 晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
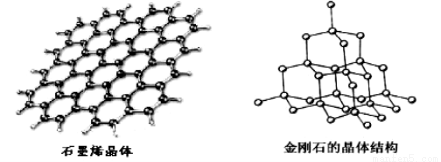
①石墨烯晶体中,每个C 原子连接 个六元环,每个六元环占有 个C 原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
查看答案和解析>>
科目: 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】聚酯增塑剂广泛应用于耐油电缆、煤气管、防水卷材、电气胶带;耐油耐汽油的特殊制品等。聚酯增塑剂G及某医药中间体H的一种合成路线如下(部分反应条件略去):
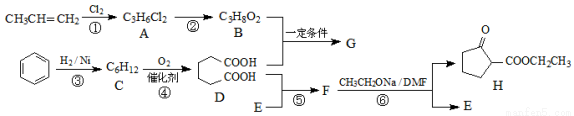
已知:

(1)B的名称(系统命名)为 。
(2)若反应①的反应条件为光照,最先得到的氯代有机物结构简式是 。
(3)写出下列反应的反应类型:反应②是 ,反应④是 。
(4)写出B与D反应生成G的反应方程式 。
(5)甲苯的二氯代物产物的同分异构体有 种。
(6)利用以上合成路线的信息,以甲苯和乙醇为原料合成下面有机物(无机试剂任选)。
请写出合成路线: 。
查看答案和解析>>
科目: 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:选择题
化学是与社会、环境等密切相关。下列有关说法中正确的是
A.发展“低碳经济”能够减少对化石能源的依赖
B.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
C.LED光源中的氮化镓(GaN)熔点为1700℃,属分子晶体
D.甲型H1N1流感病毒的蛋白质由C、H、O三种元素组成
查看答案和解析>>
科目: 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.对硝基甲苯的结构简式: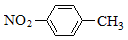
B.CH2F2的电子式: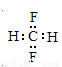
C.HClO的结构式:H -O-Cl
-O-Cl
D.CO2的比例模型:
查看答案和解析>>
科目: 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1KNO3溶液:H+、Fe2+、SCN-、SO42-
B.c(H+)/ c(OH-)=10-10mol·L-1的溶液:K+、Ba2+、NO3-、Cl-
C.pH=0的溶液:Al3+、Cl-、SO42-、CO32-
D.c(ClO-) = 1.0 mol·L-1的溶液:Na+、I-、S2-、SO42-
查看答案和解析>>
科目: 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:选择题
下列有关物质的性质与用途具有对应关系的是
A.SO2具有还原性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.氢 氧化铝具有弱碱性,可用作净水剂
氧化铝具有弱碱性,可用作净水剂
D.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com