
科目: 来源:2016-2017学年福建省四地六校高二上学期12月月考化学试卷(解析版) 题型:选择题
下图所示原电池工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是( )

A.左池电极反应式:X4+ + 2e- = X2+
B.每消耗1mol Y2O72-,转移3mol电子
C.左池中阴离子数目增加
D.在工作中,电流的方向:左池→导线→右池
查看答案和解析>>
科目: 来源:2016-2017学年福建省四地六校高二上学期12月月考化学试卷(解析版) 题型:选择题
反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
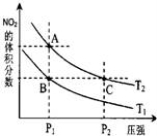
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目: 来源:2016-2017学年福建省四地六校高二上学期12月月考化学试卷(解析版) 题型:填空题
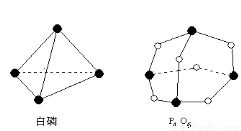
I.已知:P4(白磷)+3O2(g)= P4O6(g)的反应热△H=-1638 kJ·mol?1 ,白磷和P4O6的分子结构如图所示,化学键的键能(kJ·mol?1):P—P:198 P—O:360,则断开1molO2所需要的能量为 kJ
II.已知:①CO(g)+1/2O2(g)=CO2(g) △H=-141kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-883kJ·mol-1
(1)利用CO、H2化合制得1mol气态甲醇的热化学方程式为 ;
(2)若在恒温2L密闭容器中,将1molCO与3mol H2充分反应,当吸收能量为129KJ时,此时H2的转化率为 ,平衡常数为 。
查看答案和解析>>
科目: 来源:2016-2017学年福建省四地六校高二上学期12月月考化学试卷(解析版) 题型:填空题
25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka= ;
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为 ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为 ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是 ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
查看答案和解析>>
科目: 来源:2016-2017学年福建省四地六校高二上学期12月月考化学试卷(解析版) 题型:填空题
化学在能源开发与利用中起到十分关键的作用。甲烷是一种新型的绿色能源,又是一种重要的化工原料。甲烷燃料电池能量转化率高,具有广阔的发展前景,现用甲烷燃料电池进行如图实验(图中所用电极均为惰性电极)

(1)电极b为______________极,溶液中OH-移向_____________极(填a或b);
(2)电极a处所发生的电极反应方程式为 ;
(3)乙装置所发生的总反应方程式 ;
(4)如图装置中盛有100m L0.2mol•L-1AgNO3溶液,当氢氧燃料电池中消耗氧气56mL(标准状况下)时,则此时右图装置中溶液的pH=__________(溶液体积变化忽略不计),d极增重 g。
L0.2mol•L-1AgNO3溶液,当氢氧燃料电池中消耗氧气56mL(标准状况下)时,则此时右图装置中溶液的pH=__________(溶液体积变化忽略不计),d极增重 g。
查看答案和解析>>
科目: 来源:2016-2017学年福建省四地六校高二上学期12月月考化学试卷(解析版) 题型:填空题
700℃时,向容积为2L的密闭容器中充入一定量 的CO和H2O,发生反应:
的CO和H2O,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g)反应过程中测定的部分数据见下表(
CO2(g)+H2(g)反应过程中测定的部分数据见下表( 表中t2>t1):
表中t2>t1):
反应时间/min | n(CO)/mol | n |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)= mol 。
。
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
(4)700℃时,向容积2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
(5)该反应在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是  、 (
、 ( 写出两种)。
写出两种)。
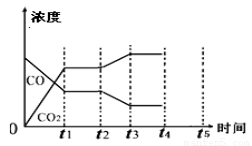
(6)若该容器体积不变,能判断反应达到平衡的是 。
①c(CO)与c(H2)的比值保持不变
②v(CO 2)正=v(H2O
2)正=v(H2O )逆
)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变
查看答案和解析>>
科目: 来源:2016-2017学年福建省四地六校高二上学期12月月考化学试卷(解析版) 题型:实验题
已知将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应H2O2+2H++2I-═2H2O+I2,且生成I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成I2完全消耗.由于溶液中I-继续被H2O2氧化,生成I2与淀粉作用,溶液立即变蓝.因此,根据试剂X量、滴入双氧水至溶液变蓝所需时间,即可推算反应H2O2+2H++2I-═2H2O+I2反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
0.1mol·L-1 KI溶液 | H2O | 0.01mol·L-1 X溶液 | 0.1mol·L-1 双氧水 | 0.1mol·L-1 稀盐酸 | |||
1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-═2H2O+I2反应速率的影响。
实验2中m= ,n= 。
(2)一定温度下,H2O2+2H++2I-═2H2O+I2,反应速率可以表示为v=k·c a(H2O2)·c b (I-)·c(H+)(k为反应速率常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=__________min;
②根据上表数据可知,a、b的值依次为 和 。
(3)若要探究温度对H2O2+2H++2I-=2H2O+I2反应速率影响,在实验中温度不宜过高且采用水浴加热,其原因是 。
查看答案和解析>>
科目: 来源:2016-2017学年福建省四地六校高一上学期12月月考化学试卷(解析版) 题型:选择题
国外宇航员吃着“牙膏和砖块”时,中国宇航员已经在太空泡茶了,每个茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防止水珠飘起来。下列说法正确的是( )
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2 852 | 714 |
A.宇航员喝茶时注入的H2O的摩尔质量是18克
B.H2O+Cl2 HCl+HClO这反应属于氧化还原反应
HCl+HClO这反应属于氧化还原反应
C.氢的三种同位素1??H、2D、3T与16O只能形成三种水分子
D.在标准状况下,1mol水的体积约是22.4L
查看答案和解析>>
科目: 来源:2016-2017学年福建省四地六校高一上学期12月月考化学试卷(解析版) 题型:选择题
同温、同压下,等体积的O2和O3两种气体,下列有关说法错误的是( )
A.所含分子数目相同 B.所含氧原子物质的量之比为2∶3
C.质量之比为2∶3 D.密度之比为3∶2
查看答案和解析>>
科目: 来源:2016-2017学年福建省四地六校高一上学期12月月考化学试卷(解析版) 题型:选择题
被称为“国防金属”的镁,60%来自于海洋,从海水中提取镁的正确方法是( )
A.海水加入石灰乳制得氢氧化镁,氢氧化镁灼烧制得氧化镁,再电解熔融氧化镁制得金属镁
B.海水加盐酸制得氯化镁,后电解熔融氯化镁制得金属镁
C.海水加入氢氧化钠溶液制得氢氧化镁,后电解氢氧 化镁制得金属镁
化镁制得金属镁
D.海水加入石灰乳制得氢氧 化镁,氢氧化镁与盐酸反应制得氯化镁,再电解熔融氯化镁制得金属镁
化镁,氢氧化镁与盐酸反应制得氯化镁,再电解熔融氯化镁制得金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com