
科目: 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:实验题
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2。某小组设计了如下实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2  3Na2S2O3+CO2。回答下列问题:
3Na2S2O3+CO2。回答下列问题:
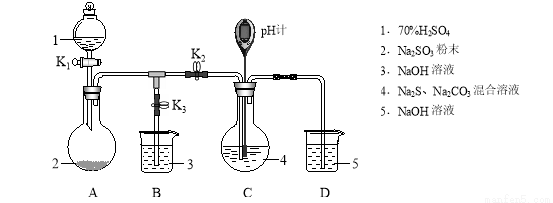
(1)装置A的作用是制备______________,反应的化学方程式为______________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): ① |
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出, ② ⅱ.pH计读数逐渐 ③ | 反应分步进行: Na2CO3+SO2 2Na2S+3SO2 Na2SO3+S |
当pH计读数接近7时,立即停止通SO2,操作是 ④ | 必须立即停止通SO2的原因是: ⑤ |
(3)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验验证该预测:取少量反应后的溶液于试管中,______________。
查看答案和解析>>
科目: 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:填空题
研究CO、NOx、SO2等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:
2NO(g)+2CO(g)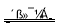 2CO2(g)+N2(g) △H=-746.8kJ·mol-1
2CO2(g)+N2(g) △H=-746.8kJ·mol-1
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是___________。
(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验 编号 | 温度 (℃) | NO初始浓度 (mol·L-1) | CO初始浓度 (mol·L-1) | 催化剂比表面积(m2·g—1) | 催化剂用量(g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 | 50 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 | 50 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 | 50 |
②图2表示NO的平衡转化率(α)随温度、压强变化的示意图。X表示的是__________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。

(2)一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g) SO3(g)+NO(g),达到平衡时SO3的体积分数为25%。该反应的平衡常数K=___________。
SO3(g)+NO(g),达到平衡时SO3的体积分数为25%。该反应的平衡常数K=___________。
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3 7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为____________。
7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为____________。
查看答案和解析>>
科目: 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:实验题
镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
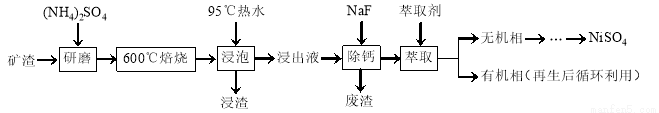
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
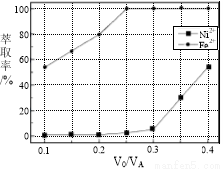
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
查看答案和解析>>
科目: 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(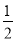 ,
,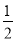 ,
,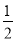 )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目: 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:推断题
[化学——选修5:有机化学基础]化合物M是一种香料,A与D是常见的有机化工原料,按下列路线合成化合物M:
已知以下信息:
①A的相对分子质量为28
回答下列问题:
(1)A的名称是___________,D的结构简式是___________。
(2)A生成B的反应类型为________,C中官能团名称为___________。
(3)E生成F的的化学方程式为___________。
(4)下列关于G的说法正确的是___________。(填标号)
a.属于芳香烃
b.可与FeCl3溶液反应显紫色
c.可与新制的Cu(OH)2共热生成红色沉淀
d.G分子中最多有14个原子共平面
(5)化合物M的同系物N比M的相对分子质量大14,N的同分异构体中同时满足下列条件的共有________种(不考虑立体异构)。
①与化合物M含有相同的官能团;②苯环上有两个取代基
(6)参照上述合成路线,化合物X与Y以物质的量之比2:1反应可得到化合物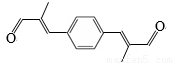 ,X的结构简式为________,Y的结构简式为________。
,X的结构简式为________,Y的结构简式为________。
查看答案和解析>>
科目: 来源:2017届湖北省高三12月月考化学试卷(解析版) 题型:选择题
化学方程式可简明地体现元素及其化合物的性质。已知
氧化还原反应:
2FeCl3+2HI=2FeCl2+I2+2HCl;
2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI;
3I2+6KOH=5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3=2KSCN+CO2↑+H2O;
KCN+CO2+H2O=HCN+KHCO3
热分解反应:
4NaClO 3NaCl+NaClO4;NaClO4
3NaCl+NaClO4;NaClO4 NaCl+2O2↑
NaCl+2O2↑
下列说法不正确的是
A.热稳定性:NaCl>NaClO4>NaClO
B.还原性(碱性溶液):Fe(OH)2>I2>KIO3
C.氧化性(酸性溶液):FeCl3>Co(OH)3>I2
D.酸性(水溶液):HSCN>H2CO3>HCN
查看答案和解析>>
科目: 来源:2017届湖北省高三12月月考化学试卷(解析版) 题型:选择题
下表中,甲、乙、丙、丁、戊分别代表一种物质,在一定条件下相邻的物质间能发生反应,不相邻物质间不能发生反应的有哪几组
组别 | 甲 | 乙 | 丙 | 丁 | 戊 |
① | SiO2 | CaCO3 | 稀HNO3 | Fe | CuSO4溶液 |
② | O2 | Fe | 稀H2SO4 | NaOH溶液 | CO2 |
③ | Cl2 | H2S | 稀HNO3 | Al(OH)3 | NaOH溶液 |
④ | CO2 | Mg | 稀HCl | CaO | Na2CO3溶液 |
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目: 来源:2017届湖北省高三12月月考化学试卷(解析版) 题型:选择题
关于下列各图像的说法中正确的是

A.图①表示将SO2气体通入溴水中
B.图②表示反应N2(g)+3H2(g) 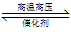 2NH3(g) ΔH<0的平衡常数K随温度的变化
2NH3(g) ΔH<0的平衡常数K随温度的变化
C.图③中阴、阳两极收集到的气体体积之比一定为1∶1
D.图④中的ΔH1<ΔH2
查看答案和解析>>
科目: 来源:2017届湖北省高三12月月考化学试卷(解析版) 题型:选择题
硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:

下列说法不正 确的是
确的是
A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
B.操作②、操作③分别是过滤与蒸发结晶
C.反应①加料之前需将反应器加热至100℃以上并通入氩气
D.反应①中氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
科目: 来源:2017届湖北省高三12月月考化学试卷(解析版) 题型:实验题
某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
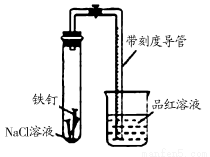
(1) 实验前用碱液清洗铁钉,再用0.100 mol/L的 H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是_________ _____。
(2) 为尽量减小误差,下列操作的正确顺序是 ___(填序号)。
①装入铁钉
②插入注射器向铁钉表面滴入适量NaCl溶液并打开止水夹
③将导管口浸入品红溶液
④塞上单孔活塞
⑤检查装置气密性
(3)实验中试管内发生的总反应化学方程式为 ;
用该实验方案测量空气中O2的体积百分数时应测量的数据是:
①导管与试管内部空间总体积,② _。
(4) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充写出假设三:
假设一:电解质溶液的pH
假设二:NaCl溶液的浓度
假设三:________________
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
液柱高度 | 0 cm | 1.3 cm | 8.5 cm | 8.4 cm | 8.5 cm | 8.5 cm |
形成稳定 液柱时间 | 3.0 min | 3.1 min | 5.1 min | 5.3 min | 15.6 min | min |
①当pH=2时,没有观察到稳定液柱形成的原因是_____________________。
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是________________。
③按上述实验装置,设计实验证明假设二。
第一步:配制不同浓度的NaCl溶液;
第二步:____________________,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com