
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
对于 aA(g)+bB(g) cC(g)反应,改变某一变量(条件)得到如下图象(p 表示压强,T 表示温度,n 表示物质的量,á 表示平衡转化率)。根据图象,下列判断正确的是
cC(g)反应,改变某一变量(条件)得到如下图象(p 表示压强,T 表示温度,n 表示物质的量,á 表示平衡转化率)。根据图象,下列判断正确的是
A.反应 I:若 p1>p2,则 a+b<c
B. 反应Ⅱ:此反应的ΔH<0,且 T1<T2
C.反应Ⅲ:表示 t1 时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示 t1 时刻增大 B 的浓度对反应速率的影响
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
pH=2.1 的两种酸溶液 A、B 各 1 mL,分别加水稀释到 100 mL,其 pH 与溶液体积的关系如图,下列说法不正确的是( )
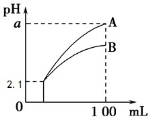
A.若 a<4.1,则 A、B 都是弱酸
B.稀释后,A 酸溶液的酸性比 B 酸溶液强
C.若 a=4.1,则 A 是强酸,B 是弱酸
D.A、B 两种酸溶液的物质的量浓度一定相等
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列条件下,对应离子一定能大量共存的是
A.在0.1mol/LNa2CO3 溶液中:Al3+、NH4+、SO42-、NO3-
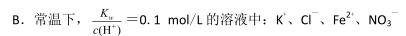
C.使甲基橙变红的溶液中:NH4+、Cl-、SO42-、Mg2+
D.25℃时,水电离出的 c(H+)=1×l0-l3 mol/L 的溶液中:K+、Ba2+、NO3-、S2-
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
25℃时,在 10 mL 浓度为 0.1 mol/L 的 NH3·H2O 溶液中滴加 0.1 mol/L 盐酸,下列有关
描述正确的是( )
A.加入 5 mL 盐酸时: c(NH4+) > c(Cl-) >c(OH-)>c(H+)
B.加入 10 mL 盐酸时:c(NH4+)+c(H+)=c(OH-) +c(Cl-)
C.在溶液 pH=7 时:水的电离程度最大
D.加入 20 mL 盐酸时:c(Cl-)=2c(NH4+)
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列有关问题,与盐的水解无关的是( )
A.NH4Cl 与 ZnCl2 溶液可作焊接金属中的除锈剂
B.用 NaHSO4 去除暖手瓶中的水垢
C.实验室盛放 Na2CO3 溶液的试剂瓶不能用磨口玻璃塞
D.加热蒸干 AlCl3 溶液得到 Al(OH)3 固体
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
含碳的化合物之间很容易发生转化。请回答下列问题:
(1)有机物 M 在有光的时候很容易转化成 N,其过程如下:

M 到 N 过程中,光能转化为 能;其中较稳定的物质是 (用 M、N 回答)。
(1)已知(l)的燃烧热为3267.5kJ·mol-1,
(2)(l)+6O2(g)═6CO2(g)+3H2(g)△H=akJ·mol-1,
则 a -3267.5(填“>”、“<”或“=”)。
(3)在标准状态即压力为 100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化 合物时的反应热称为该化合物的标准摩尔生成焓(△H¢)。已知 100kPa,一定温度下:
Fe2 O 3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ·mol-1
CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ·mol-1
C(石墨)+O 2 ( g)=CO2 (g) △H=-390.5kJ·mol
则 Fe2O3 的标准摩尔生成焓△H= _____________。
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
已知 25 ℃时部分弱电解质的电离平衡常数数据如下表:

回答下列问题:
(1)写出碳酸的主要的电离方程式 。若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+) 原来的十分之一(填“大于”、“小于”或“等于”).
(2))物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为 (用编号填写)。
a.CH3COONa b. Na2CO3 c. NaClO d.NaHCO3 e.NaSCN
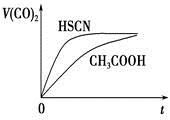
(3)25℃时,将 20mL0.1mol·L-1CH COOH 溶液和 20mL0.1mol·L-1HSCN 溶液分别与 20mL0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图。反应初始阶段两种溶液产生 CO2 气体的速率存在明显差异的原因是 反应结束后,假设 NaHCO3 完全反应且气体全部逸出,则所得两溶液中,c(CH3COO-) _c(SCN-)(填“>”、“<”或“=”;)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)―c(CH3COO-)=_ mol/L(填代入数据后的计算式,不必算出具体数值)。
(5)向 NaClO 溶液中通入少量的 CO2,发生反应的离子方程式为 __________
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:实验题
化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。
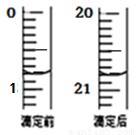
(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com