
科目: 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的pH=4
B.此酸的电离平衡常数约为1×10-7
C.升高温度,溶液的pH增大
D.由HA 电离出的c(H+) 约为水电离出的c(H+) 的106倍
约为水电离出的c(H+) 的106倍
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
一定条件下存在反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在条件下开始反应。达到平衡时,下列说法正确的是( )
2SO3(g) ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在条件下开始反应。达到平衡时,下列说法正确的是( ) 
A.容器I、Ⅲ中平衡常数相同
B.容器Ⅱ、Ⅲ中正反应速率始终相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:Ⅱ>Ⅲ
D.容器I中SO2的转化率与容器Ⅱ中的转化率之和等于1
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液(设混合后溶液体积等于混合前两液体体积之和),两者pH都升高了1,则加入水和加入NaOH溶液的体积比约为( )
A.11:1 B.10:1 C.6:1 D.5:1
B.10:1 C.6:1 D.5:1
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:填空题
已知:25℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1000mL,溶液pH数值范围为___________,溶液中 ___________(填“增大”“减小”“不
___________(填“增大”“减小”“不 变”或“不能确定”)。
变”或“不能确定”)。
②25℃时,0.1mol/L氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________,25℃时,氨水电离平衡常数约为___________。
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中 ___________(填序号)。
___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL0.1mol/LNaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。
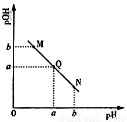
图中M、Q、N三点所示溶液呈中性的点是___________(填字母)。
图中M、Q、N三点所示溶液中水的电离程度最大的点是___________(填字母)。
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:填空题
已知:氮气和氢气合成氨反应为:N2(g)+3H2(g) 2NH3(g) ΔH=-92kJ/mol请回答下列问题:
2NH3(g) ΔH=-92kJ/mol请回答下列问题:
(1)取1 mo l N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量___________92kJ(填“大于”、“等于”或“小于”)
l N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量___________92kJ(填“大于”、“等于”或“小于”) ;若升高温度,上述反应中ΔH___________(填“变大”、“变小”或“不变
;若升高温度,上述反应中ΔH___________(填“变大”、“变小”或“不变 ”)。
”)。
(2)已知:分别破坏1molN H键、1mol H
H键、1mol H H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N N键需要吸收的能量为___________。
N键需要吸收的能量为___________。
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molNH3(g) 并发生上述反应。半分钟后反应达到平衡,测得v(NH3)=0.40mol/(L•min),则N2(g)+3H2(g)  2NH3(g) 反应的平衡常数为___________。
2NH3(g) 反应的平衡常数为___________。
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:实验题
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题。(有关实验药品为:市售食用白醋样品500mL、0.1000mol/LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液)。
实验步骤:
A.用滴定管量取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却)稀释至刻度线,摇匀即得待测食醋溶液。
B.用酸式滴定管取待测食醋溶液20.00mL于锥形瓶中,并滴加酚酞指示剂待用。
C.碱式滴定管盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数。
D.滴定,并记录NaOH的终读数。重复滴定2-3次。
E.实验数据记录
1 | 2 | 3 | 4 | |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
(1)则c(样品)/moL•L-1=_________;样品总酸量=_________g/100mL。
(2)判断D步骤操作时溶液到达滴定终点的方法是________________。
(3)若上述B步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果产生的影响是_________(填“无影响”、“偏大”或“偏小”,下同);若在D步骤用碱式滴定管时开始没有气泡,后产生气泡,则对滴定结果产生的影响是___________;若D步骤滴定前平视读数,滴定终点时俯视读数 ,则对滴定结果产生的影响是__________。
,则对滴定结果产生的影响是__________。
查看答案和解析>>
科目: 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:填空题
已知可逆反应CO(g)+H2O(g) CO2(g)+H2(g),达到平衡时。
CO2(g)+H2(g),达到平衡时。
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为____________;K值为_________。
(2)830K,若只将起始时c(H2O)改为6mol/L,其他条件不变,则水蒸气的转化率为____________。
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,a、b、c之间的关系式是___________。
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
对 N2+3H2 2NH3 反应,仅改变下列一个条件,就能提高活化分子的浓度从而加快正反应速率的是( )
2NH3 反应,仅改变下列一个条件,就能提高活化分子的浓度从而加快正反应速率的是( )
A.加热 B.增大体积 C.加负催化剂 D.补充 He
查看答案和解析>>
科目: 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
已知 X2(g)+Y2 (g)  2Z(g),X2、Y2、Z 的起始浓度分别为 0.1mol·L-1、0.3mol·L-1、0.2mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
2Z(g),X2、Y2、Z 的起始浓度分别为 0.1mol·L-1、0.3mol·L-1、0.2mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A.Z 为 0.4 mol·L-1 B.X2 为 0.2 mol·L-1
C.Y2为 0.4 mol·L-1 D.Z 为 0.3 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com