
科目: 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:填空题
煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。(1)已知:
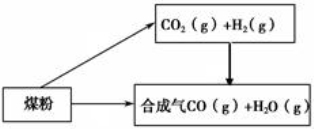
①C(s) + H2O(g) = CO(g)+H2(g) ΔH=+131.3 kJ·mol -1
-1
②CO2(g) + H2(g) = CO(g) + H2O(g) ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生 成二氧化碳和氢气的热化学方程式为
成二氧化碳和氢气的热化学方程式为
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g) N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 (3)研究表明:反应CO(g)+H2O(g)
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下达到平衡时,CO的转化率为 (4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
图1中A极产生的气体在标准状况下的体积为 ②电极为C、D的装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是 (填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5.0 mol·L-1NaOH溶液。 查看答案和解析>> 科目: 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:填空题 元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用直接沉淀法、还原沉淀法、电解法。 I.直接沉淀法 (1)已知含铬废水中存在着平衡: Ⅱ.还原沉淀法
(2)下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号) A.FeSO4溶液 B.浓H2SO4溶液 C.酸性KMnO4溶液 D.Na2SO3溶液 (3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为 (4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示: (5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。 常温下,某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 ,当Cr3+浓度小于10-5mol/L时可认为沉淀完全,处理后测得溶液的PH=6,则溶液过滤后 (填“能”或“否”)直接排放 Ⅲ.电解法 (6)该法是用铁作电极点解含Cr2O72-的酸性废水,电解时阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀,反应中1mol Cr2O72-完全生成Cr(OH)3沉淀,外电路 查看答案和解析>> 科目: 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:选择题 在下列变化:①大气固氮,②硝酸银分解,③实验室制取氨气。按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列正确的是 A.①②③ B.②①③ C.③②① D.③①② 查看答案和解析>> 科目: 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:选择题 下列有关物质的性质与用途有对应关系的是 A.Si有良好的半导体性能,可以用于。 B.氨气具有还原性,可用作制冷剂 C.Na2O2呈浅黄色,可用作潜水艇中的供氧剂 D.明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂 查看答案和解析>> 科目: 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:选择题 下列有关NA的说法正确的是 A.标准状况下,将2.24L Cl2溶于水,可得到HC1O分子的数目是0.lNA B.NA个Fe(OH)3胶体粒子的质量为107g C.8.0gCu2S和CuO的混合物中含有铜原子数为0.lNA D.2.3gNa与氧气完全反应,反应中转移的电子数介于0.lNA到0.2NA之间 查看答案和解析>> 科目: 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是 A.在0.01mol/LBa(OH)2溶液中:Al3+、NH4+、NO3-、HCO3- B.0.1 mol/L的FeCl2溶液中:H+、Al3+、SO42-、ClO- C.滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、I- D.由水电离产生的c(H+)=l×l0-3mol/L的溶液中:Na+、B a2+、NO3-、Cl- 查看答案和解析>> 科目: 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:选择题 下列离子方程式书写正确的是 A.NaAl(SO4)2溶液中滴加Ba(OH)2直至SO42-沉淀完全: 2Al3++ 6OH-+ 3SO42-+ 3Ba2+= 2Al(OH)3↓+3BaSO4↓ B.NH4HS溶液与少量的NaOH溶液反应:NH4++ OH-= NH3·H2O C.稀H2SO4和Na2S2O3溶液共热:S2O32-+2H+=SO2↑+S↓+H2O D.过量Cl2通入FeI2溶液中:3C12+2I-+ 4Fe2+= 4C1-+I2+4Fe3+ 查看答案和解析>> 科目: 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:选择题 下列实验能达到实验目的是 A.检验淀粉的水解是否水解完全,取水解后的溶液加入I2观察溶液是否变蓝色。 B.苯的溴代反应,用溴水与苯混和加入铁粉 C.Fe(NO3)2中Fe2+的检验是在Fe(NO3)2中加入稀硫酸后加入KMnO4溶液,观察Fe(NO3)2溶液是否褪色。 D.铝热反应的实验中,将氧化铁与铝粉混合后,插入用砂纸打磨的镁条,用燃烧的小木条点燃镁条。 查看答案和解析>> 科目: 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:选择题 下列实验对应的现象及结论均正确且两者具有因果关系的是
查看答案和解析>> 科目: 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:选择题 实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O。关于该反应的下列说法正确的是 A.N2既是氧化产物又是还原产物 B.每生成1 mol N2转移电子的物质的量为6 mol C.NH4Cl中的氮元素被还原 D.NaNO2是还原剂 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |