
科目: 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:选择题
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )
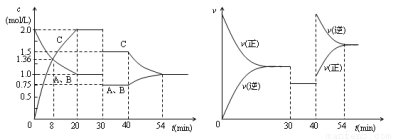
A.前20min B的平均反应速率为0.05mol·L-1·min-1
B.8 min时表示正反应速率等于逆反应速率
C.反应方程式中的x=1,30 min时表示增大压强
D.40 min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:选择题
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( )
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( )

A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变深
C.乙组操作时,C1上发生的电极反应为I2+2e-═2I-
D.乙组操作时,C2做正极
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:选择题
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )

A.b点对应的Ksp等于c点对应的Ksp
B.采取蒸发溶剂的方法可以使溶液从a点变到b点
C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5
D.0.02mol·L-1的AgNO3溶液与的0. 2mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:选择题
以铜为电极,amol/L的硫酸铜溶液作电解液,对含有铁、锌、银的粗铜进行电解精炼,下列叙述正确的是( )
①粗铜应与电源的负极相连
②当有1mol精铜析出时,就有2NA个电子通过电解质溶液
③阴极上的反应只有:Cu2++2e-=Cu
④电解结束时,c(CuSO4)<amol/L
⑤杂质银以Ag2SO4的形式沉入电解池中形成"阳极泥"
A.②③ B.①③⑤ C.①②④⑤ D.③④
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:选择题
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,下列说法不正确的是( )
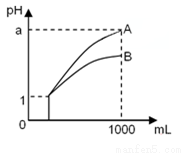
若a<4,则A、B 都是弱酸;
②稀释后,A酸溶液的酸性比B酸溶液强;
③若a=4,则A是强酸,B是弱酸;
④A、B两种酸溶液的物质的量浓度一定相等.
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:选择题
由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎,下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
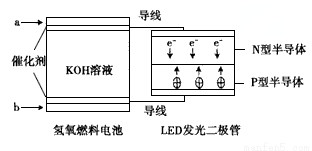
A.电池负极电极反应式为H2-2e-+2OH-=2H2O
B.a处通入氧气,b处通入氢气
C.该装置中能量转化只涉及两种形式的能量
D.P一型半导体连接的是电池负极
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:选择题
500mLKNO3和Cu(NO3)2的混合溶液中,C(NO3-)=6.0mol/L。用石墨作电极电解此溶液,当通电一段时间后,两极都收集到22.4L气体(标准状况).假设电解后溶液的体积仍为500 mL。下列说法正确的是( )
A.原混合溶液中K+的浓度为1mol/L B.上述电解过程中共转移4mol电子
C.电解得到的Cu的物质的量为0.5mol D.电解后溶液中H+的浓度为2mol/L
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:填空题
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)(1)4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填序号);


(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:
CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。
CO2(g)+H2(g) ΔH<0。
820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为___________
②平衡时,甲容器中CO的转化率是 。比较下列容器中CO的转化率:乙 甲;丙 甲(填“>”、“=”或“<”)。
③丙容器中,通过改变温度,使CO的平衡转化率增大,则温度 (填“升高”或“降低”),平衡常数K (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:填空题
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(2)如图是0.1 mol·L-1该溶液pH随温度变化的图像。
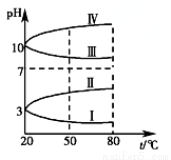
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是_______________________;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)≈________。(用具体数值表示)
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
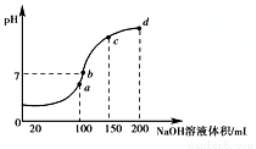
试分析图中a、b、c、d四个点,水的电离程度最大是________;在b点,溶液中各离子浓度由大到小的排列顺序是______________________。
查看答案和解析>>
科目: 来源:2016-2017学年吉林省高二上学期期末化学试卷(解析版) 题型:填空题
食醋的总酸量即一定体积的食醋原液所含醋酸的质量,单位是g· L-1或个g/100mL。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)用酸碱滴定法测定某食醋样品中的总酸量时,下列说法中正确的是 。
A.用NaOH溶液滴定时反应的离子方程式为H++OH-=H2O
B.食醋样品不需要预先稀释一定倍数后可以直接进行滴定
C.用NaOH溶液滴定时,可使用酚酞或甲基橙作指示剂
D.若测得样品的物质的量浓度为0.75mol·L-1,则其总酸量为45g·L-1
(2)某同学仔细观察该食醋样品的标签,发现其中还含有作为食品添加剂的苯甲酸钠(C6H5COONa),他想用理论验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下醋酸与苯甲酸的 。
A.pH B.电离度 C.电离常数 D.溶解度
(3)常温下,用0.1000mol· L-1 NaOH溶液分别滴定20.00mL 0.1000mol· L-1 HCl溶液和20.00mL 0.1000mol· L-1 CH3COOH溶液,得到两条滴定曲线,如图所示。
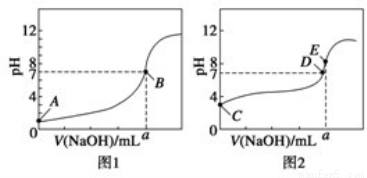
①滴定醋酸溶液的曲线是 (填“图1”或“图2”);滴定曲线中a= mL;
②E点pH>8的原因是(用离子方程式表示): 。
(4)测定食醋的总酸量实验中,配制NaOH溶液和稀释食醋所用的蒸馏水必须煮沸,目的是 。
(5)实验时,吸取食醋样品10mL于100mL容量瓶中定容。移取定容后的溶液20mL于锥形瓶中,加入1~2滴指示剂,用浓度为c mol·L-1的NaOH标准溶液滴定,平行测定三次,消耗NaOH溶液的平均体积为V mL。则原食醋样品的总酸量=____________g/100mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com