
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:选择题
常温下,将体积为V1 的 0.1000mol·L-1 HCl 溶液逐滴加入到体积为V2的0.1000mol·L-1Na2CO3 溶液中,溶液中H2CO3、HCO3-、CO32-所占的物质的量分数(α)随pH的变化曲线如图。下列说法不正确的是

A.在pH=10.3时,溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-)
B.在pH=8.3时,溶液中:0.1000>c(HCO3-)+c(CO32-)+c(H2CO3)
C.在pH=6.3时,溶液中,c(Na+)>c(Cl-)>c(HCO3-)>c(H+)>c(OH-)
D.V1:V2=1:2时,c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
查看答案和解析>>
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:选择题
某固体粉末样品中可能含有SiO2、Fe2O3、CaO、CuO、MgO、Na2O和炭粉等成分,为确认其中的组分,某同学设计并完成了如下实验:
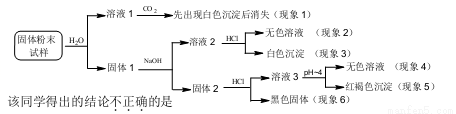
A.从现象1和3可推断样品中有CaO,没有Na2O
B.从现象3可推断样品中有SiO2
C.从现象4和5可推断样品中有Fe2O3和MgO
D.从现象4和6可推断样品中有炭粉,无CuO
查看答案和解析>>
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:填空题
从乙烯出发可以合成乙醇、乙醛、乙酸和乙酸乙酯等。
(1)若在乙酸中混有乙醛,请设计实验方案检验其中乙醛的存在(要求写出实验操作、现象、结论和出现明显实验现象的化学反应方程式)__ _。
(2)已知: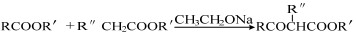 +R′OH,写出乙酸乙酯在乙醇钠条件下发生取代反应的化学方程式__ _ _。
+R′OH,写出乙酸乙酯在乙醇钠条件下发生取代反应的化学方程式__ _ _。
查看答案和解析>>
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:填空题
某废液中含有Fe3+、Cu2+、Ag+金属离子,某研究小组设计的处理方案如下(假如各步骤所加试剂都过量):
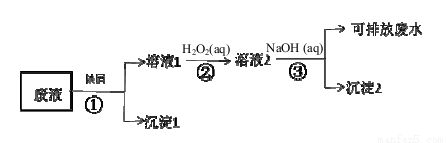
(1)沉淀1的主要成分是_________(用元素符号表示),沉淀2化学式为___ ___。
(2)步骤②发生反应的离子方程式 。
查看答案和解析>>
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:实验题
已知:草酸(乙二酸)的钠盐和钾盐易溶于水、而钙盐难溶于水;草酸晶体(H2C2O4·2H2O) 受热会脱水和升华,草酸晶体熔点101℃,170℃以上分解。为检验草酸晶体的分解产物进行如图实验。回答下列问题:
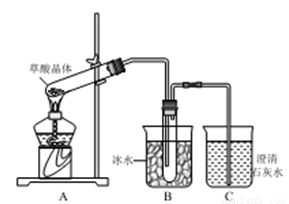
(1)实验前需检验装置气密性,检验方法是_________________。
(2)对草酸晶体进行图示实验,在装置C中可观察到有气泡逸出,且澄清石灰水变浑浊,则说明草酸晶体分解的产物中有CO2。对此结论的合理性作出判断并说明理由____________。
查看答案和解析>>
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:填空题
为研究(NH4)2SO4和NH4HSO4混合物样品组成,称取四份该样品分别逐滴加入相同浓度的NaOH溶液25.0 mL,加热并完全反应,产生NH3的体积(NH3的体积已折算成标准状况,不考虑NH3在水中的溶解)如下表:
实验序号 | I | II | III | IV |
NaOH体积(mL) | 25.0 | 25.0 | 25.0 | 25.0 |
样品质量(g) | 3.62 | 5.43 | 7.24 | 10.86 |
NH3体积(mL) | 896 | 1344 | 1344 | 896 |
(1)样品中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(2)NaOH溶液的物质的量浓度为 。
查看答案和解析>>
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:填空题
由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)  CH3OH(g) +H2O(g) △H1=-49.58 kJ•mol-1
CH3OH(g) +H2O(g) △H1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+ H2(g)  CO (g)+H2O(g) △H2
CO (g)+H2O(g) △H2
反应Ⅲ:CO(g)+2 H2(g)  CH3OH(g) △H 3=-90.77 kJ•mol-1
CH3OH(g) △H 3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅲ自发进行条件是 (填“低温”、“高温”或“任何温度”)。
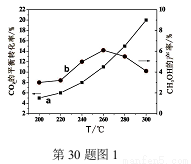
(2)某研究小组将一定量的H2和CO2充入恒容密闭容器中,在合适的催化剂条件下发生了反应I、Ⅱ、Ⅲ,不同温度下体系达到平衡时测得CO2的转化率(a)及CH3OH的产率(b)变化如图1所示。
①该反应达到平衡后,为再提高反应速率同时提高甲醇的生成量,可采取的措施有 。
A改用高效催化剂 B升高温度 C缩小容器体积 D分离出甲醇 E增加CO2的浓度
②据图1,当温度高于260℃时,CO2的平衡转化率随温度的升高继续增加,而CH3OH的产率却反而下降,请说明理由 。
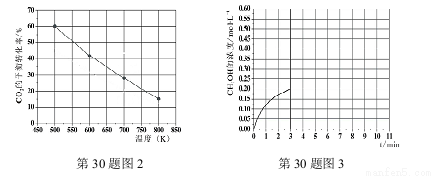
(3)已知:在2L恒容密闭容器中充入3mol H2和1.5mol CO2(一定条件下,仅考虑发生反应Ⅰ),实验测得在不同温度下,反应体系中CO2的平衡转化率与温度的关系曲线如图2所示。实验测得:在500K时,反应Ⅰ经10min时达到平衡,假如其他条件不变,当反应时间进行到3min时,迅速将反应温度升至600K进行实验,请在图3中画出3~10min内容器中CH3OH浓度的后续变化总趋势图。
查看答案和解析>>
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:实验题
工业上湿法制高铁酸钾的基本流程如下:
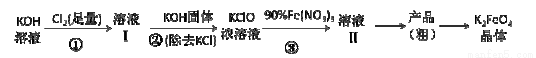
已知:高铁酸盐热稳定性差
回答下列问题:
(1)第③步发生反应的离子方程式 。
(2)第③步反应的体系,温度不宜过高,并最好控制温度在 30℃以下,其原因是 。
(3)通过结晶方法从溶液II得到的粗产品中主要含有杂质 (填化学式),可通过重结晶法提纯K2FeO4,具体操作步骤有:将粗产品先用饱和KOH溶液溶解,然后浓缩、冷却结晶、过滤、洗涤、干燥。其干燥可采用的方法是 (写出一种干燥方法)。
(4)利用电化学原理,用铁钉和氢氧化钾溶液为原料可以获得K2FeO4。在制备过程中铁钉作______极,请写出获得FeO42-的电极反应式 。
查看答案和解析>>
科目: 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:实验题
有机物G是重要的有机合成中间体,从原料X出发合成G的路线如下:
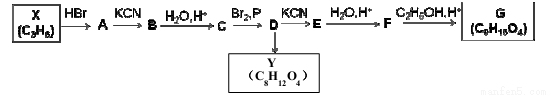
已知:①X能使溴水和酸性KMnO4均褪色;G的分子结构中有3种不同环境的氢;Y的分子结构中含有酯基,且只有1种环境的氢。
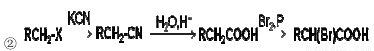
请回答下列问题:
(1)生成A的反应类型 。
(2)写出物质C的结构简式 。
(3)写出F→G的化学反应方程式 。
(4)写出满足下列条件的C的所有同分异构体的结构简式
a 、能发生水解反应 b、能发生银镜反应
(5)设计以D为原料制备Y的合成路线(用流程图表示;无机试剂任选)
查看答案和解析>>
科目: 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
下列有关说法正确的是
A.当H2O与Na2O2反应生成1molO2时,转移的电子数目为2×6.02×1023
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.常温下2S2O(g) 3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
D.氯水通入SO2后溶液的酸性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com